Расшифровка полиморфизмов генов системы свертываемости крови (тромбофилия)
Генетические анализы при потерях беременности

Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
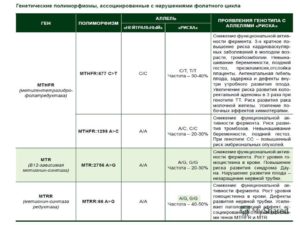
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Для мутантов:) Расшифровка значения полиморфизма генов — полиморфизм гена асе
Сама долго рылась — искала, чтоб по-русски было объяснено, какой ген, что означает. Вот, может, кому еще пригодится: что означают полиморфизмы генов
Генетические факторы риска привычного невынашивания беременности
Комплекс исследования — Генетические факторы риска привычного невынашивания беременности включает в себя анализ на:
- полиморфизм G20210А гена II фактора свертываемости крови ( протромбина)
- полиморфизм G1691А гена V фактора свертываемости крови (лейденского фактора)
- полиморфизм С667Т гена метилентетрагидрофолатредуктазы ( МТНFR)
- полиморфизм 4 G/5 G гена ингибитора активатора плазминогена ( РАI-1)
- полиморфизм VaI34Leu гена фактора XIII свертываемости крови (F13)
- полиморфизм D/I гена ангиотензинпревращающего фермента ( АСЕ)
- полиморфизм А1/А2 гена CYP17 **
Привычное невынашивание беременности тесно связано с генетическими нарушениями. Риск невынашивания складывается из нескольких составляющих:
- Нарушение тромбообразования.
- Нарушение тромболизиса.
- Нарушении синтеза половых гормонов.
При повышенной склонности к тромбообразованию, нарушается система гемостаза. Генетические нарушения у женщин с наследственной тромбофилией проявляются при беременности. Предрасположенность к тромбофилии является причиной привычного невынашивания, задержки развития плода, гестозов, нарушения развития плаценты.
Генетические факторы риска
Замедление процессов фибринолиза при мутации генов PAI -1 является причиной нарушения процесса имплантации плода.
Мутация 6754/5G приводит к повышению фибрина в сосудах матки, снижению плацентарного кровообращения, что в свою очередь является причиной задержки развития плода.
Полиморфизм гена MTHFR, который является ферментом метаболизма продукта гомоцистеина. В норме это вещество не накапливается, при генетическом нарушении оно поражает сосуды и способствует образованию тромбов.
Полиморфизм гена F5 который отвечает за антикоагуляционные реакции, приводит к осложнениям беременности, невынашиванию, отставанию развития плода, поздним выкидышам, образованию тромбов в плаценте.
Мутация гена F2, который отвечает за образование протромбина, участвующего в свертывании крови, приводит к повышению его уровня в два раза. Полиморфизм этого гена является фактором всех осложнений беременности.
Ген F 13 отвечает за образование фибриназы. При мутации этого гена повышается активность фибриназы при нормальном ее количестве.
При полиморфизме гена АСЕ, отвечающего за повышение артериального давления, приводит к развитию одного из самых опасных осложнений беременности — эклампсии.
Изменения гена CYP17, отвечающего за образование стероидных гормонов, при генотипе А2/А2 и А1/А2 значительно увеличивает риск невынашивания.
Полиморфизм гена АСЕ
Ген АСЕ участвует в превращении неактивного ангиотензина в активный. Это вещество является одним из самых активных веществ, которые повышают артериальное давление. В связи с этим могут развиваться артериальные гипертензии, эндотелиальная дисфункция, тяжелое осложнение у беременных — эклампсия.
Полиморфизм коагуляционного фактора F5 (V)
Фактор играет важную роль в регуляции свертываемости крови — образование тромбина. Мутация G1691A (мутация Лейден) приводит к гиперкоагуляции и к риску развития образования тромбов в венозных сосудах, артериальным тромбоэмболиям. Полиморфизм гена повышает риск развития коронарного стеноза, инфаркта миокарда и инсульта.
Полиморфизм коагуляционного фактора F2 (20210 G)
Коагуляционный фактор F2 (протромбин) участвует в процессах свертываемости крови (образованию кровяных сгустков). Полиморфизм 20210 G приводит к увеличению протромбина в два раза. Повышается риск возникновения тромбофилии, сердечно-сосудистым заболеваниям.
Полиморфизм гена MTHFR (С677Т)
Факторотвечает за синтез фолиевой кислоты, а также является ферментом метаболизма гомоцистеина, который токсически действует на сосуды. Накопление гомоцистеина приводит к коронарному атеросклерозу. Мутация гена приводит к ишемическим заболеваниям сердца, инфаркту миокарда, атеросклерозу, осложнениям беременности, дефектам развития плода.
Полиморфизм коагуляционного фактора F7 (Arg353Gln)
Фактор активирует систему свертывания крови образованию кровяного сгустка. Высокий уровень F7 повышает риск стеноза коронарных сосудов и инфаркта миокарда.
Полиморфизм тромбоцитарного рецептора фибриногена
Фактор обеспечивает быстрое склеивание тромбоцитов и купирование поврежденного эпителия. Мутация гена приводит к повышенной агрегации тромбоцитов и образованию тромбов, что приводит к сердечно-сосудистым заболеваниям. Терапия аспирином у пациентов с мутацией данного фактора не эффективна.
Полиморфизм A фибриногена (455 G)
Фибриноген при повреждении сосудов переходит в фибрин и образует кровяные сгустки. Мутация может привести к повышенной выработке фибриногена в крови и создает высокий риск образования тромбов. Это приводит к повышенному давлению крови, инсультам и тромбоэмболическим заболеваниям. Риск инсультов при этом может увеличиться в 4 раза.Источник тут
Е
сли забить в поисковик на этом сайте «полиморфизм», то там выскакивает много ссылок про еще разные гены, если кому-то этих не хватит))) вкратце и по-русски.
Полиморфизм генов при тромбофилии
Каждый человек уникален, и эта уникальность возможна благодаря индивидуальному сочетанию генов (генотипу). Общий набор генов у всех людей одинаков, он определяет характерные признаки с точки зрения всего вида. Неповторимые отличия каждого организма возникают благодаря различным комбинациям элементов ДНК.
Клетки ДНК, расположенные на одинаковых участках хромосомы (локусах) и предусматривающие разные состояния одного и того же признака, являются полиморфными (polys — многий и morphe — вид, форма, образ). Их двойственная природа обусловлена разными аллелями, или, по-другому, формами.
Разные аллели возникают вследствие мутации, то есть спонтанного или направленного под воздействием провоцирующих факторов изменения структуры ДНК. Полиморфизм генов определяет индивидуальные различия в развитии физических или психических признаков человека, но кроме этого, он обуславливает предрасположенность к тем или иным заболеваниям.
В тех случаях, когда мутации определяют не наличие самой патологии, а только предрасположенность к ней, она может развиться только под воздействием определенных внешних или внутренних факторов.
В частности, генетическая тромбофилия может начать развиваться из-за беременности или воздействия заболеваний сердечно-сосудистой системы – мерцательной аритмии, артериальной гипертензии, варикозного расширения вен и т. д.
Даже под воздействием провоцирующих факторов тромбофилия развивается не у всех склонных к этому людей, все зависит от индивидуальных особенностей организма.
У большинства пациентов с предрасположенностью к образованию тромбов эта особенность является именно врожденной, то есть приобретенной еще во время внутриутробного развития.
В этом случае есть два варианта возникновения полиморфизма.
Во-первых, он может возникнуть в результате объединения разных аллелей отца и матери в одном гене, во-вторых, полиморфный ген может быть полностью унаследован от одного из родителей.
У каждого человека может быть множество полиморфных генов, но не все из них могут привести к возникновению тромбофилии. Некоторые из них обуславливают вполне безобидные отличия конкретного человека от других, другие дают начало генетическим заболеваниям. На возникновение тромбофилии может повлиять всего несколько генов, которые относятся к системе свертывания крови.
Полиморфизм протромбина
Протромбин (коагуляционный фактор II или F2) – это одна из главных составляющих свертывающей системы. Это сложная белковая структура, которая предшествует тромбину – главному ферменту гемостаза (свертывания), который непосредственно участвует в формировании тромбов. При проведении анализа на полиморфизм протромбина можно получить следующие результаты:
- Протромбиновое время. Это значение, выраженное в секундах, которое соответствует показателю времени свертываемости крови. В норме протроибированное время должно находиться в диапазоне 9-12,6 секунд.
- Протромбиновый индекс. Это показатель, вычисляемый, как отношение протромбинового времени пациента к нормативному значению для конкретного возраста и пола в процентах. Нормальным считается протромбиновый индекс в пределах от 77 до 120%.
- Протромбин по Квику. Это наиболее современный и точный анализ на полиморфизм протромбина. Результат исследования рассчитывается в виде соотношения активности плазмы пациента и нормативного значения контрольной плазмы в процентах. Нормальным показателем считается 78-142%.
На возникновение предрасположенности к тромбозам влияет повышенный протромбиновый индекс, который может превышать норму в 1,5-2 раза. Возникающая мутация наследуется по аутосомно-доминантному типу, то есть даже если ген второго родителя будет нормальным, ребенок унаследует полиморфизм, который может привести или не привести к тромбофилии.
Мутация Лейден
Полиморфизм лейденского фактора (фактора V) коагуляционной системы является одним из наиболее опасных в плане риска развития тромбоза. Этот компонент процесса свертывания, или, по-другому, проакцелерин, является белком, синтезирующимся в печени. Он представляет собой кофактор, то есть вспомогательный элемент, который участвует в преобразовании протромбина в тромбин.
Мутация Лейден встречается у 5% всего населения планеты, а конкретно у пациентов, страдающих от тромбоза, эта особенность встречается в 20-40%. При этом если оба родители обладали полиморфным геном проакцелерина, то риск развития тромбофилии у ребенка составляет 80%, если же явление встречалось только у отца или у матери, вероятность 7%.
Риск развития тромбофилии при мутации лейденского фактора повышается при наличии следующих провоцирующих факторов:
- хирургические вмешательства, особенно на органах малого таза;
- период после операции или травмы, предполагающий длительное статическое положение;
- злокачественные опухоли;
- избыточный вес;
- хронические заболевания сердечно-сосудистой системы;
- прием лекарств из некоторых фармакологических групп;
- прием оральных контрацептивов (противозачаточных таблеток) и других гормональных средств;
- беременность, роды и послеродовой период;
- частые длительные переезды и перелеты;
- частая катетеризация вен;
- обезвоживание.
У большинства людей с наличием лишь одного мутировавшего гена проакцелерина при нормальной второй аллели за всю жизнь не возникает ни одного случая тромбоза. Если же полиморфный ген представлен сразу двумя измененными аллелями, то без регулярных профилактических мир предотвратить влияние тромбофилии практически невозможно.
Полиморфизм фактора VII
Фактор VII или F7 (проконвертин) – это элемент свертывающей системы крови, который участвует в раннем этапе формирования тромба. Совместно с некоторыми другими факторами гемостаза он способствует активации фактора X, который, в свою очередь, переводит протромбин из пассивного состояния в активное и способствует образованию тромбина.
Проконвертин синтезируется в печени под воздействием витамина K.
В отличие от полиморфизма других генов, мутация фактора VII при тромбофилии оказывает положительное влияние. Изменение в первичной структуре проконвертина способствует снижению его ферментной активности, то есть он будет в меньше степени влиять на активацию преобразования протромбина в тромбин.
Полиморфизм гена фактора VII гемостаза влияет не только на снижение риска развития тромбоза, но также на уменьшение вероятности возникновения невынашивания беременности, то есть выкидыша. Также под воздействием мутации снижается риск инфаркта миокарда, а если он все же случается, то вероятность летального исхода так же уменьшается. Однако вместе с тем повышается риск кровотечений.
Полиморфизм фибриногена
Фибриноген (фактор I, F1) – это специфический белок, который находится в крови в растворенном виде и при кровотечении является основой для формирования кровяного сгустка. Под влиянием тромбина этот компонент преобразуется в фибрин, который под воздействием ферментов преобразуется непосредственно в тромб.
Фибриноген называют F1, поскольку он был обнаружен учеными самым первым.
Полиморфизм фибриногена значительно повышает вероятность образования тромба, однако в большинстве случаев это происходит под влиянием внешних негативных факторов. К ним относятся воспалительные, инфекционные и аутоиммунные патологии. Также могут повлиять следующие провокаторы:
- сахарный диабет;
- избыточный вес;
- злокачественные новообразования;
- острый инфаркт миокарда;
- травмы кожи;
- курение;
- гепатиты;
- туберкулез.
Следует также учитывать, что при сдаче анализов на повышение уровня фибриногена может повлиять стресс, предшествующая интенсивная физическая нагрузка, повышенный уровень холестерина, прием оральных контрацептивов и т. д. Не рекомендуется проводить исследование при простудных заболеваниях.
Анализы на полиморфизм генов
Полиморфизм генов диагностируется с помощью специфического анализа крови, сдаваемой из вены утром натощак.
Проходить такое обследование можно в клинических диагностических центрах или частных больница, поскольку в государственных поликлиниках такую услугу не предоставляют.
Стоит подготовиться к тому, что каждый анализ может стоить от 1,5 до 4 тысяч рублей, а их может понадобиться несколько.
Назначение на каждый анализ дает лечащий врач по результатам общего исследования крови. Направить на обследование может любой специалист – терапевт, хирург, флеболог и т. д., но расшифровывать результаты должен только гематолог. Не стоит пытаться сделать заключение самостоятельно.Нередко анализ на полиморфизм генов назначается во время беременности, поскольку тромбофилия в период вынашивания ребенка может привести к непоправимым последствиям.
К ним относится задержка внутриутробного развития плода, замирание беременности, выкидыш и преждевременные роды.
Несмотря на это, каждая женщина с таким диагнозом может родить здорового ребенка без применения кесарева сечения, если будет полностью придерживаться рекомендаций врача.
Анализы на тромбофилию
Чтобы обнаружить генетическую предрасположенность (ГП) к тромбообразованию пациентам, назначаются анализы на тромбофилию.
Практическое значение лабораторных методов очень важно — они позволяют выяснить причины нарушения свертываемости крови, спрогнозировать развитие тромботических осложнений и тем самым уменьшить частоту наиболее распространенных заболеваний, таких как тромбоз, тромбофлебит, легочная эмболия и др.
Особенно важно своевременное выявление тромбофилии при беременности. Зная диагноз пациентки, врач сможет обеспечить ей грамотное медицинское сопровождение до самых родов.
Причины и симптомы
Основной причиной заболевания является недостаточность регуляторных механизмов, ограничивающих образование сгустков крови.
Кровяные сгустки формируются при свертывании крови для восстановления поврежденных сосудов в результате биохимических реакций между специальными клетками (тромбоцитами) и белками (факторами свертываемости), которые ответственны за регуляцию процессов гемореологии и гемостаза. При расстройстве этих процессов тромбы начинают образовываться без видимой причины и блокировать приток крови к окружающим тканям. Такая тенденция к повышенному образованию сгустков крови называется гематогенная тромбофилия.
Если у пациента выявлена тромбофилия, то клинические проявления будут зависеть от места нахождения сгустков, степени нарушения кровообращения, сопутствующей патологии, возраста и пола пациента.
Основной симптом — это частое образование тромбов, болезненность в месте их локализации, нарастающая отечность.
Развитие заболевания могут спровоцировать генетические и экологические факторы, поэтому тромбофильные аномалии подразделяются на наследственные и приобретенные.
Наследственная тромбофилия
Генетический дефект обуславливает образование большого количества кровяных сгустков у молодых людей.
Основные признаки — возникновение множественных тромбозов у относительно молодых людей без видимых причин.
Наследственная тромбофилия обусловлена генетическими дефектами, которые присутствуют с самого рождения. Наибольшая предрасположенность к врожденной форме появляется, когда оба родителя — носители дефектных генов.
Чаще всего встречаются следующие аномалии:
- дефицит антитромбина III и белка C и S, которые отвечают за повышенное образование сгустков;
- фактор V Лейден, препятствующий свободному кровотоку.
Приобретенная тромбофилия
Встречается в старшем возрасте и возникает в результате аутоиммунных расстройств, гормональных дисбалансов и заболеваний, которые приводят к уменьшению кровотока через вены и артерии. Аномальная свертываемость может появиться после серьезных операций, катетеризации сосудов, длительной иммобилизации, при беременности и употреблении гормональных оральных контрацептивов.
Когда необходимы тесты?
Обследование и анализ на генетическую тромбофилию необходимо сделать при таких обстоятельствах, как:
Если беременность протекает с осложнениями, то женщине нужно дополнительное обследование.
- повторный тромбоз;
- единичный или множественный тромбоз в сравнительно молодом возрасте;
- планирование беременности;
- возникшие осложнения при вынашивании ребенка;
- онкологические и системные недуги;
- последствия сложных операций, тяжелых ранений, инфекций.
Какие анализы проводятся?
Для исследования берется венозная кровь, которая содержит генетические маркеры тромбофилии, информацию о составе, вязкости, свертываемости. Для этого пациенту проводится коагулограмма — базовый анализ крови на тромбофилию, позволяющий диагностировать проблемы с гемостазом и гемореологией. Он включает определение таких параметров, как:
- время свертывания крови;
- АЧТВ;
- протромбиновый индекс;
- тромбированное время;
- концентрация фибриногена;
- фибринолитическая активность;
- активированное время рекальцификации;
- период лизиса (растворения) эуглобулинового сгустка;
- активность антитромбинов;
- факторы свертывания;
- Д-димер и др.
Чтобы выявить генную мутацию, необходимо дополнительно обследоваться.
Отдельное обследование назначают при подозрении на генетическую мутацию, чтобы выявить полиморфизм генов и подтвердить врожденную предрасположенность к заболеванию. Для этого необходимо выполнение специфических анализов.
Определение формы генетических особенностей дает возможность выбрать тактику лечения для пациентов, у которых обнаружилась генная мутация.
Анализ на наследственную тромбофилию включает обнаружение наиболее часто наследуемых полиморфизмов:
- гены свертывания крови — F2, фактор V-Лейден, F7, F13 и др;
- мутация антитромбина 3;
- дефицит протеинов С и S;
- ген MTHFR;
- ген ингибитора активатора плазминогена PAI-1 4G/5G и др.
Анализы можно сдать в лабораториях, где имеются все условия для изучения материала. В крупных медицинских центрах патология диагностируется с помощью специальной тест-системы «Кардиогенетика тромбофилии».
При планировании беременности проводят скрининг-тесты. Основное требование к подготовке — воздержание от пищи в течение 8 часов перед анализом.
Иногда необходима дифференциальная диагностика, чтобы отличить заболевание от гемофилии.
Расшифровка анализа, нормы и отклонения
Полиморфизм генов не является непременным критерием развития заболевания, но обуславливает больший риск его развития, особенно при воздействии различных внешних факторов.
Исследование может дать положительный результат.
Генотип полиморфизма у пациента может быть представлен такими вариантами:
- GG — норма;
- А/А — гомозигота;
- G/А — гетерозигота.
Результаты анализа на тромбофилию указывают на присутствие или отсутствие мутации. Исследование крови может показать следующие результаты:
- Мутаций не выявлено.
- Гомозиготная — указывает на присутствие двух генов с измененной структурой, поэтому вероятность проявления заболевания высокая.
- Гетерозиготная. Означает, что пациент — носитель одного измененного гена, и вероятность заболевания невысокая.
Расшифровка анализа по полиморфизму генов показана в таблице:
| Уровень фибриногена | GG | GA | AA |
| F13 | GT | TT | |
| Фактор V-Лейдена | GA | AA | |
| F2 | |||
| Ингибитор активатора плазминогена | 5G/5G | 4G/5G | 4G/4G |
Оценивать данные, полученные в ходе исследования крови, должен профильный врач.
На основании этих данных формируется заключение прогностического характера о генетической предрасположенности человека к развитию тромбофилии и о степени риска появления тромбоза.
При исследовании крови в лаборатории используются различные методики, поэтому показатели могут немного отличаться. Оценка результатов должна проводиться в соответствии с нормативами отдельной лаборатории врачом-гематологом.
Норма отдельных показателей коагулораммы крови показана в таблице:
| Протромбированный индекс | 72—120% |
| Тромбированное время | 11—18 секунд |
| Свертывание | 5—10 минут |
| Активированное время рекальцификации | 50 -70 мин. |
| Антитромбин 3 | 72—126% |
| D-димер | 250—500 нг/мл |
| Фибриноген В | Негативный |
| Тромботест | IV-V степень |
Плазменные факторы системы свертывания крови. Исследование полиморфизмов в генах: F2 (20210, G>A), F5 (R534Q, G>A), F7 (R353Q, G>A), FGB (455, G>A), SERPINE1/PAI-1 (-675, 5G>4G)

array(20) { [«catalog_code»]=> string(6) «180014» [«name»]=> string(248) «Плазменные факторы системы свертывания крови.
Исследование полиморфизмов в генах: F2 (20210, G>A), F5 (R534Q, G>A), F7 (R353Q, G>A), FGB (455, G>A), SERPINE1/PAI-1 (-675, 5G>4G)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3069» [«url»]=> string(53) «plazmennyje-faktory-sistemy-svertyvanija-krovi_180014» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
» [«opisanie»]=> string(12438) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Исследование полиморфизмов в генах:
- F2 (протромбин, 20210, G>A), rs1799963
- F5 (мутация Лейдена, R534Q, G>A), rs6025
- F7 (коагуляционный фактор VII, R353Q, G>A), rs6046
- FGB (фибриногенA), rs1800790
- SERPINE1 или PAI-1 (ингибитор активатора плазминогена, – 675, 5G>4G), rs1799768
Полиморфизмы в генах, кодирующие плазменные факторы системы свертывания крови повышают вероятность возникновения венозных тромбозов и связанных с ними осложнений, в первую очередь, в венах нижних конечностей, а также в мозговых, брыжеечных, печеночных и портальной венах.
Одновременное выявление нескольких генетических факторов предрасположенности к тромбофилическим состояниям значительно увеличивает риск развития тромбозов.
К примеру, одновременное выявление у пациента аллелей риска в генах F2 и F5 повышает риск развития тромбозов в 22 раза, а их отдельное определение только в 2 раза.
Знание о наличии у человека врожденной тромбофилии, смешанной тромбофилии или просто повышенного генетического риска тромбообразования существенно влияет:
- на предоперационную подготовку и ведение послеоперационного периода;
- на подготовку и ведение беременности и родов;
- на разработку индивидуальной профилактики тромбоза и назначение ряда препаратов и пр.
Необходимо помнить о дополнительных факторах, повышающих риск развития тромбофилии:
- повышенное артериальное давление;
- склеротические изменения сосудов;
- повышенный уровень холестерина;
- вредные привычки (злоупотребление спиртными напитками, курением и др.);
- тяжелые патологические процессы и заболевания (злокачественные опухоли, лучевая болезнь, заболевания внутренних органов, в особенности печени).
Данное исследование направлено на выявление полиморфных мутаций в генах, активизирующих или деактивирующих различные звенья свертывающей системы крови и повышающих или снижающих вероятность образования венозных тромбозов.
Определение нуклеотидной последовательности соответствующих генетических локусов проводится методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Преимущества метода:
- высокая прогностическая значимость выявляемых факторов риска;
- точность определения генотипа;
- анализ на наличие мутаций достаточно провести 1 раз в жизни.
Показания к исследованию:
- Досимптоматическое определение риска развития венозных тромбозов;
- Повторные случаи венозных тромбоэмболий;
- Первый эпизод венозных тромбоэмболий в возрасте до 50 лет;
- Первый эпизод венозных тромбоэмболий при отсутствии средовых факторов риска в любом возрасте;
- Первый эпизод венозных тромбоэмболий с необычной анатомической локализацией (мозговые, брыжеечные, печеночные, портальная вены и т.д.);
- Первый эпизод венозных тромбоэмболий у лиц в любом возрасте, имеющих родственников первой степени родства (родители, дети, сестры, братья) с тромбозами до 50 лет;
- Первый эпизод венозных тромбоэмболий, возникший во время беременности, в послеродовом периоде или во время приема оральных контрацептивов;
- Необъяснимая внутриутробная гибель плода во время второго или третьего триместра беременности, нарушения структуры и функции плаценты, патология родов, задержка развития плода;
- Первый эпизод венозных тромбоэмболий, при приеме заместительной гормональной терапии;
- Ишемическая болезнь сердца, артериальная гипертензия, атеросклероз или венозный тромбоз;
- Антифосфолипидный синдром.
Интерпретация результатов:
Для каждого полиморфизма в бланке ответа в графе «Результат» указывается его аллельное состояние: «Гетерозигота» или «Гомозигота».
Пример результата исследования. Полиморфизмы в генах, кодирующие плазменные факторы системы свертывания крови
| Полиморфизм в гене F2 (протромбин, 20210, G>A), rs1799963 | GA |
| Полиморфизм в гене F5 (мутация Лейдена, R534Q, G>A), rs6025 | AA |
| Полиморфизм в гене F7 (коагуляционный фактор VII, R353Q, G>A), rs6046 | GG |
| Полиморфизм в гене FGB (фибриноген, 455,G>A), rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена, – 675, 5G>4G), rs1799768 | 5G/4G |
Анализ: генетическая тромбофилия или полиморфизм генов
Часто читатели задают вопрос: какой «анализ на тромбофилию» надо сдать, если есть склонность к тромбозам, или тромбозы были в семье. Про анализы при «генетической тромбофилии» и про «полиморфизм генов» подробно рассказывает врач Власенко Наталья Александровна
Врожденная или генетическая тромбофилия
Если коротко, то список рекомендованных анализов на генетическую тромбофилию включает перечисленные стандартные тесты, а при особых показаниях могут быть исследованы некоторые другие генетические факторы. Подробнее на сайте www.pynny. ru
Нажмите на таблицу для увеличения
Как же распознать генетическую тромбофилию?
Подобные диагнозы и последующее лечение определяет врач – человек, который учился этому 6-7 лет, а не “знатоки” на форумах.
Собрать анамнез, выяснить жалобы, провести осмотр – это то, что может сделать доктор на приеме. Но для постановки диагноза “генетическая тромбофилия” этого мало. Обязательно нужно сдать лабораторные анализы на тромбофилию.
Даже название заболевания нам “сообщает”, что консультация генетика необходима. Подразумевается, что в каком-то гене есть аномалия, которая определяет склонность к томбообразованию. Задача врача-генетика выяснить в каком именно гене это произошло с помощью лабораторого обследования.
Чтобы не возникало сомнений в необходимости подтверждения диагноза и лечения генетической томбофилии, нужно понимать: почему?
Для здоровья опасна не сама тромбофилия, а ее осложнения (инфаркт, инсульт, ТЭЛА, тромбоз мезентериальных сосудов и др.).
Во-первых, изменить генотип мы не можем, поэтому с наличием генетической тромбофилии нужно смириться.
Во-вторых, эндогенные и экзогенные факторы могут способствовать “старту” тромбофилии. То есть, если генетическая предрасположенность есть, то определенные факторы могут спровоцировать развитие этого состояния. Поэтому, о наличии своих особенностях в генах надо знать, чтобы понимать насколько опасны/полезны могут быть совершенные действия.В-третьих, при оперативном вмешательстве или инвазивном обследовании отсутствие информации о наличии генетической тромбофилии может значительно повлиять на исход мероприятия.
В-четвертых, предупредить заболевание гораздо проще, чем лечить. Поэтому, разумно корректируя двигательную активность и подбирая правильно рацион питания, ведется профилактика осложнений тромбофилии.
В пятых, для каждой причины тромбофилии, подбирается индивидуальное лечение. Поэтому, консультироваться у доктора и сдавать анализы необходимо.
Анализы на генетическую тромбофилию
Сначала сдаются неспецифические анализы крови (первый этап), исследования, которые используются для диагностики не только тромбофилии. Они определяют, что есть нарушения в системе свертывания крови.
Это общий анализ крови, АЧТВ, определение Д-димера, количественное исследование антитромбина III, фибриногена.
При подозрении на тромбофилию в общем анализе должен насторожить повышенный уровень эритроцитов и тромбоцитов.
Активированное частичное тромбопластиновое время АЧТВ – временной интервал, за который образуется сгусток. Этот показатель определяет степень активности факторов свертывания. Снижение этого показателя крови может свидетельствовать о тромбофилии.
Д-димер – вещество, которое образуется при разрушении тромба, результат расщепления фибрина.
Его наличие в крови возможно при фибринолизе и тромбообразовании. По сути, это маркер этих процессов. При тромбофилии, соответственно, его количество увеличится.
Уровень антитромбина III также будет занижен, так как именно он активирует противосвертывающую систему крови. По названию понятно, что этот белок
препятствует образованию тромбов в кровяном русле.
Фибриноген – белок, вырабатываемый печенью. Он является основой для образования тромба. Процесс выглядит так: фибриноген-фибрин-тромб.
При тромбофилии показатель повышен.
Они позволяют дифференцировать тробмофилию с другими заболеваниями.
Волчаночный антикоагулянт – это специфический белок, который разрушает клеточные мембаны сосудов, прикрепляясь к ним, он начинает участвовать в процессе свертывания крови, провоцируя тромбозы. ВА является иммуноглобалином, это антитело против фосфолипидов. Его появление возможно при аутоиммунных процессах.
Антифосфолипидные антитела. Их несколько видов и наименований (и в том числе – волчаночный антикоагулянт). Они также способны разрушать клеточные мембраны. При увеличении их количества можно думать об антифосфолипидном синдроме.
Высокий гомоцистеин встречается и при гиповитаминозе вит. группы В, адинамии, злоупотреблении никотином.
Полиморфизм генов тромбофилии
Генетические исследования при тромбофилии – это отдельный разговор.
Существует понятие «полиморфизм генов». Чтобы понимать для чего нужен анализ на генетическую тромбофилию, нужно знать, что конкретно мы исследуем.
Полиморфизм генов – это разнообразие генов. Если сказать точнее, то один ген может быть представлен несколькими вариантами (аллелями).
На молекулярном уровне это выглядит, как “поезд с вагонами”, где поезд – это ген, а вагоны – нуклеотиды ДНК. Когда “вагоны” выпадают из состава или меняют свою последовательность – это полиморфизм генов. И вариаций может быть миллион.
Предрасположенность к генетической тромбофилии определяют определенные гены, точнее их мутации, аномальные изменения. Для подтверждения или исключения диагноза проводят комплексное обследование. Все гены, которые “заинтересованы” (могут влиять) на развитие болезни исследуются на молекулярном уровне.
Для определения полиморфизма генов берут на анализ либо кровь, либо эпителий со щеки. Обычно исследуется 8 (минимум) – 14 полиморфизмов.
Самые распространенные мутации
- полиморфизм пятого фактора свертывания крови (фактор Лейдена);
В мутантном гене происходит замещение гуанина на аденин, как следствие, меняются свойства аминокислоты.Наследуется по аутосомно-доминантному типу;
- мутация второго фактора свертывания крови (протромбин).Также замещается аденином гуанин, но в другой позиции.
Этот полиморфизм может иметь значение для прогноза заболевания у пациентов, принимающих гормональные препараты;
- полиморфизм I фактора свертываемости крови – фибриногена. В норме фибриноген превращается в фибрин, затем происходит образование тромба.
При этой мутации процент фибриногена выше, что увеличивает риск образования тромба; - полиморфизм седьмого фактора свертывания крови. Является ферментом, активатором IX и X факторов. С помощью
седьмого фактора происходит образование кровяного сгустка. Когда активируется X фактор, то одновременно происходит активация протромбина, который после превращается в тромбин; - полиморфизм XII фактора свертывания крови характеризуется снижением активности фермента. Из-за этого “качество” фибриновых волокон и сгустка страдает, и фибринолиз происходит быстрее;
- аномалии тромбоцитарных рецепторов к коллагену и фибриногену. При изменении свойств рецепторов увеличивается скорость адгезии тромбоцитов и происходит гиперагрегация тромбоцитов. Такой полиморфизм страшен риском ТЭЛА, инфаркта, невынашиванием беременности, послеоперационными тромбозами.
- антагонист активатора плазминогена изменяет эффективность активации плазминогена, подавляет процесс фибринолиза.
Изменяется количество повторов гуанина. Бывает 5 последовательностей повторов оснований гуанина (5G) и 4 повтора оснований гуанина (4G). Второй вариант имеет неблагоприятное прогностическое значение; - полиморфизмы дефицита протеинов С и S. Эти два “брата-протеины” являются ингибиторами тромбообразования, то есть препятствуют ему. При их дефиците – тромбы образуются активнее.Протеины С и S “работают в команде”. Их основная цель – разрушить V и VIII
факторы свертываемости крови, чтобы предотвратить выпадение фибрина. Протеин S является кофактором протеина C.
Сейчас такие информативные генетические обследования доступны каждому пациенту. Бережное и внимательное отношение к своему здоровью – залог прекрасного качества жизни независимо от возраста!
