ОЛЛ с филадельфийской хромосомой
Острый лимфобластный лейкоз у детей. Клинические рекомендации
- Острый лимфобластный лейкоз
- Ph+-ОЛЛ
- Транслокация (9;22)
- Транслокация (4;11)
- Транслокация (12;21)
- Метотрексат
- L-аспарагиназа
- Винкристин
- Антрациклины
- 6-меркаптопурин
- Дети
- Подростки
- Индукция
- Консолидация
- Поддерживающая терапия
- Лучевая терапия
- Химиотерапия
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ВОЗ – Всемирная Организация Здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
д.м.н. – доктор медицинских наук
КТ – компьютерная томография
ЛДГ — лактатдегидрогеназа
МОБ – минимальная остаточная болезнь
МРТ – магнитно-резонансная томография
ОЛЛ – острый лимфобластный лейкоз
ПХТ – полихимиотерапия
СОЛ – синдром острого лизиса опухоли
ТГСК – трансплантация гемопоэтических стволовых клеток
УЗИ – ультразвуковое исследование
ЦНС – центральная нервная система
ЧМН – черепно-мозговые нервы
ЭКГ – электрокардиография
Эхо-КГ – эхокардиография
Ph+-ОЛЛ – острый лимфобластный лейкоз с наличием Филадельфийской хромосомы – t(9;22)/BCR-ABL
Термины и определения
Полная ремиссия – отсутствие клинических проявлений заболевания при наличии ? 5% бластных клеток в костном мозге при нормальном соотношении других ростков кроветворения и отсутствии экстрамедуллярных проявлений.
Рецидив – это появление морфологически выявляемых бластных клеток после периода, в течение которого идентифицировать опухолевые клетки доступными методами не представлялось возможным.
Костномозговой рецидив – обнаружение в костном мозге 25% и более лимфобластов, без одновременного поражения ЦНС и/или другого экстрамедулярного поражения после констатации ремиссии.
ЦНС-рецидив (нейрорецидив)– появление лимфобластов в ликворе при цитологическом исследовании, а также неврологическая симптоматика, не связанная с другими заболеваниями и повреждениями.
При внутричерепном образовании на КТ/МРТ и при отсутствии бластных клеток в ликворе, крови и костном мозге, для диагностики изолированного рецидива ЦНС необходимо получить гистологическое подтверждение или провести однофотонную эмиссионную КТ головного мозга.
В костном мозге число бластных клеток должно составлять менее 5%.
Тестикулярный рецидив – изолированный рецидив яичка диагностируется при появлении одно- или двустороннего безболезненного яичка и значительного увеличения его плотности при пальпации при наличии в костном мозге ?5% лимфобластов и отсутствии поражения ЦНС и требует гистологического подтверждения.
Комбинированные рецидивы: сочетание двух и более поражений различной локализации. При комбинированных рецидивах костный мозг считается пораженным при наличии 5% и более лимфобластов.
Рефрактерность – отсутствие полной ремиссии в сроки, определенные протоколом терапии.
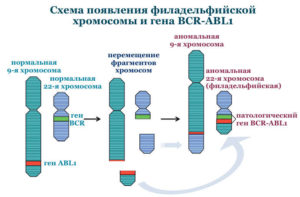
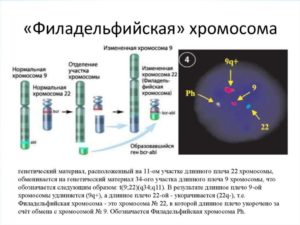
Ph-позитивный ОЛЛ– ОЛЛ с наличием транслокации (9;22)(q34;q11) – t(9;22) или BCR-ABL.
Минимальная остаточная болезнь (МОБ; minimal residual disease – MRD) – наличие остаточных лейкемических клеток у пациента в ремиссии, не выявляемых рутинными морфологическими методами.
Бессобытийная выживаемость (event-free survival – EFS) – рассчитывается от даты начала лечения до любого «отрицательного» события или даты последней явки больного. Под «отрицательным» событием понимают рецидив, смерть по любой причине, развитие второй опухоли или рефрактерность.
1.1 Определение
Острый лимфобластный лейкоз (ОЛЛ) – это злокачественное заболевание системы кроветворения, состоящее в появлении опухолевого клона из клеток линий лимфоидной дифференцировки, составляющего не менее 25% от других ядерных клеточных элементов, и в своем естественном течении неизбежно приводящее к фатальному исходу [1-4].
1.2 Этиология и патогенез
Точные причины развития ОЛЛ не установлены. Рассматривается возможная роль различных предрасполагающих факторов (генетических, вирусных, радиация, химическое и физическое воздействие и др.), однако их точное влияние на развитие ОЛЛ на сегодняшний день не установлено.
По современным представлениям в основе патогенеза ОЛЛ лежит мутация стволовой клетки, которая приводит к потере способности к нормальной клеточной дифференцировке и нарушениям в процессах пролиферации и апоптоза.
Мутантный клон достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз.
Вытеснение нормальных гемопоэтических клеток и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении и тромбоцитопении, что проявляется соответствующей клинической картиной. Опухолевые клетки могут покидать костный мозг и инфильтрировать различные органы и ткани (селезенку, печень, лимфоузлы, тимус, центральную нервную систему (ЦНС), кожу и др.) [1-4].
1.3 Эпидемиология
ОЛЛ составляет около 25 % от всех злокачественных опухолей у больных в возрасте до 18 лет и является самым частым онкологическим заболеванием детского возраста.
Заболеваемость составляет около 4 на 100 000 детского населения. Пик заболеваемости ОЛЛ у детей приходится на дошкольный возраст (2 – 5 лет при медиане 4,7 года).
Несколько чаще болеют мальчики – соотношение 1,6:1 для В-линейного и 4:1 для Т-линейного ОЛЛ [2,3,5]
1.4 Кодирование по МКБ-10
С91.0 – острый лимфобластный лейкоз
1.5 Классификация
Классификация ОЛЛ у детей согласно ВОЗ является общепринятой [4-7]:
- ОЛЛ из В-клеток предшественников
Цитогенетические подгруппы:
- t (9;22)(q34;q11); BCR-ABL, Ph+-ALL
- t (11q23)/MLL реаранжировка
- t (1;19)(q23;p13), E2A/PBX1
- t(12;21)(p12;q22), ETV6/RUNX1
- ОЛЛ из Т-клеток предшественников
2.1 Жалобы и анамнез
Клинические симптомы ОЛЛ у детей обусловлены степенью инфильтрации костного мозга лимфобластами и экстрамедуллярным распространением процесса. Пациенты с ОЛЛ могут предъявлять жалобы на слабость, лихорадку, недомогание, боли в костях и/или суставах, кровоточивость со слизистых оболочек (носовые, десневые, желудочно-кишечные и др.
кровотечения), геморрагический синдром на коже, бледность. Распространение бластных клеток в лимфатические узлы и паренхиматозные органы приводит к лимфаденопатии, увеличению печени и селезенки, проявляющихся болями в животе, расширению средостения с возможным развитием синдрома сдавления, увеличению яичек у мальчиков.
Проявлениями нейролейкемии могут быть симптомы поражения черепно-мозговых нервов, общемозговые, менингеальные симптомы [1-4].
Сбор анамнеза при ОЛЛ подразумевает тщательный расспрос о текущей или проводимой ранее лекарственной терапии, сопутствующих системных заболеваниях и хронической патологии, наличии онкологических заболеваний у родственников.Обязателен сбор эпидемиологического анамнеза семьи: условия проживания, санитарно-гигиенический уровень окружения, наличие хронических инфекционных заболеваний у близких родственников. Очень важно уточнить, откуда поступил больной: из дома или из других лечебных учреждений.
Если больной в последнее время лечился в других больницах, обязательно нужно выяснить все детали терапии, в особенности противоинфекционной терапии, а также наличие или отсутствие различных лечебно-диагностических манипуляций, таких как катетеризация, наркоз, интубация, ИВЛ.
2.2 Физикальное обследование
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела, а также детальную оценку состояния всех органов и систем и неврологического статуса.
Особое внимание следует обратить на документирование проявлений основного заболевания (описание всех групп увеличенных лимфоузлов с размерами, размеры печени и селезенки (указываются в сантиметрах ниже края реберной дуги по среднеключичной линии), размеры яичек у мальчиков, наличие/отсутствие лейкемидов на коже) и выявление возможных очагов инфекции. [1-4].
2.3 Лабораторная диагностика
Верификация диагноза проводится с помощью цитологического и цитохимического исследования мазков костного мозга и периферической крови, мультипараметрической проточной цитофлюорометрии клеток костного мозга и цитогенетического и молекулярно-генетического анализа опухолевых лимфобластов [1-4]. Диагностический период не должен занимать более 2-х суток.
- Общий клинический (развернутый) анализ крови с обязательным цитологическим исследованием мазков рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Острый лимфобластный лейкоз: симптомы, прогноз и клинические рекомендации

Лейкемия – это злокачественный процесс в кроветворном органе, нарушающий функционирование органов и систем человека.
Известны разновидности лейкозов, отличающихся способами формирования атипичных клеток. Лейкозы бывают острыми и хроническими.
Для хронических характерно длительное развитие заболевания без явных симптомов. Острые формы развиваются быстро и активно поражают весь организм человека.
Острый лимфобластный лейкоз (ОЛЛ) – это гетерогенный процесс, вызывающий онкологическую патологию, при которой поражается система кроветворения, а именно костный мозг. Патологию провоцирует неконтролируемый процесс деления лимфобластов.
Для болезни характерны анемия, интоксикация всего организма, воспаление печени, лимфатических узлов и селезёнки, нарушение функций дыхания и спонтанные кровотечения. Лечением занимаются онкогематологи. Диагноз определяется по результатам инструментальных и лабораторных исследований. Код по МКБ-10 у рака крови С91.
У детей онкологический процесс развивается до десяти раз чаще, чем у взрослых. Обычно диагностируется у представителей сильного пола в возрасте от рождения до шести лет. У девочек болезнь возникает реже. В детстве лейкемия является первичным заболеванием, во взрослом выступает в качестве осложнения диагноза «Хронический лимфоцитарный рак».
В сравнении с другими видами заболевания, острая лимфобластная лейкемия может поражать головной и спинной мозг. Прогрессируют изменения в центральной нервной системе.
Острая лимфобластная лейкемия
По определению Всемирной организации здравоохранения патология классифицируется как:
- Пре-пре-В-клеточный рак;
- Пре-В-клеточная лейкемия;
- В-клеточный лейкоз;
- Т-клеточный рак крови.
В-клеточная острая лимфобластная лейкемия определяется у 85% людей с ОЛЛ. В зону риска попадает трехлетний возраст детей или развивается после 60 лет. Распространена опухоль обычного типа В2.
Т-линейный рак определяется у 15% пациентов обычно в подростковом периоде.
Этиология заболевания
При патологии нарушается кроветворение под воздействием клона злокачественного характера. Его представляют неконтролируемые, постоянно делящиеся бласты. Клон создается из-за генетических нарушений, в ходе которых наблюдается обмен участками хромосом (транслокация), потеря участка (делеция), переворот участка (инверсия) и создание подобного участка (амплификация).
Раковая клетка закладывается на генетическом уровне во время формирования плода. Долгие годы она находится в спящем состоянии, но активируется при внешних агрессивных влияниях на организм.
Вторая группа крови сильней остальных подвержена острой лимфобластной лейкемии.
Заболевание развивается под действием следующих факторов:
- Повышенный радиационный фон в месте проживания человека.
- Работа с ионизирующим излучением.
- Частые рентгенологические исследования. Взаимосвязь с патологией только предполагается. Во время проведения диагностики под негативное влияние попадает кроветворный процесс организма, однако доза излучений невелика и онкология развивается в крайнем случае.
- Радиационное облучение при лечении злокачественных опухолей. 10% онкобольных сталкиваются с острым раковым состоянием крови после лечебного курса. Рак может проявляться в течение 10 лет.
- Острая форма лимфобластной лейкемии развивается на фоне инфекционных заболеваний.
- История болезни кровных родственников содержит онкологические процессы.
- У ребёнка болезнь может развиться, если родители с рождения создавали стерильные условия. Иммунитет не будет работать при контакте с патогенными возбудителями болезней. Ребёнок должен знакомиться с окружающим миром, контактировать с животными и чужими людьми. Простуды закаляют защитные силы организма, поэтому не нужно их бояться.
Причины развития острого течения лейкоза заключаются в контакте беременной женщины с опасными химическими элементами, при генетических отклонениях плода, к примеру, синдромах Дауна, Швахмана, Фанкони, Клайнфельтера, Вискотта-Олдрича. Педиатрия изучает влияние других патологий на раковый процесс. Рак ребёнка связывают с курением матери в период вынашивания плода.
В патогенезе отмечается развитие атипичных клеток в костном мозге, которые провоцируют нарушение кроветворения. Возникновение цитопений может сопровождаться кровотечениями слизистых и внутренними кровотечениями.
Острую лимфобластную лейкемию взрослых ассоциируют с филадельфийской хромосомой, характерной для В-клеточного рака. Другая форма острого течения заболевания – миелобластный лейкоз. В костном мозге пролиферируется предшественник гранулоцитов. Нелимфобластный рак связывают с переносом участка филадельфийской хромосомы.
Стадии патологии
В онкологической практике острый лейкоз делится на следующие стадии:
- Первая фаза имеет скрытое течение. В костном мозге зарождается злокачественный процесс, падает или поднимается уровень лейкоцитов. Формируются бласты.
- При развернутом этапе болезнь проявляется классическими симптомами. Процесс кроветворения нарушен. Инфекции активно поражают организм. Анализ крови определяет патологическое состояние.
- Рак крови проходит временно или полностью. Во время полной ремиссии восстанавливается уровень кровяных телец. Прекращаются мутации в кроветворном органе. Если болезнь отступает не полностью, на фоне хорошего самочувствия лимфоидный орган содержит повышенное количество бластов.
- Вторичный рак или рецидив характеризуется повторным поражением костного мозга или развитием новообразования в другом органе.
- На терминальной стадии незрелые лейкоциты распространяются по всем тканям и органам. Угнетаются функции систем человеческого тела. Лечение не приносит результатов. Присутствует постоянная угроза жизни пациента.
Клиническая картина
Симптомы для острого лейкоза развиваются в течение одного месяца. Лимфобласт делится, его количество стремительно растет. Увеличение бластов провоцирует замену здоровых клеток костного мозга на атипичные. Кроветворительный процесс нарушается, начинается метастазирование. Вторичное новообразование возникает в любом органе тела.
https://www.youtube.com/watch?v=9L2fgTdUUSg
Для больного ребёнка характерны следующие синдромы:
- Сонливость.
- Бледность кожных покровов вследствие анемии.
- Снижение активности. Ребёнок не хочет играть.
- Потеря веса и отсутствие аппетита.
Симптомы вызывает снижение эритроцитов в сыворотке крови. Снижается уровень кислорода в тканях.
Частые инфекционные заболевания развиваются но фоне снижения лимфоцитов и полном или частичном отсутствии гранулоцитов. К симптомам присоединяется высокая температура. При снижении уровня тромбоцитов происходит поражение кожных покровов ярко-розовой сыпью. Болезнь может характеризоваться воспалениями слизистой рта.
В процесс вовлекается лимфатическая система. Отмечается увеличение узлов на шее, в области подмышек и в паху. Лимфоузлы болят и мешают активным действиям.
Когда опухоль развивается в полостях костей, у ребёнка нарушается двигательная активность. Наблюдается ломота и боль в конечностях.
Внутренние органы при контакте со злокачественными клетками отекают и увеличиваются. Печень и селезёнка значительно выпирают над уровнем кожи. Пациент испытывает боль при пальпации органов. Характерны острые боли в органах брюшной полости, расстройства стула.
Когда лейкоз добирается до головного мозга, развиваются эпилептические припадки, тошнота, головокружение, расстройство координации и зрения. Возникают симптомы менингита, при которых пациент испытывает невыносимые головные боли. Повышается внутричерепное давление. При этом прогноз на жизнь сводится к нулю.
Развитие анемии вызывает учащённое сердцебиение, головокружение и бледность кожных покровов. Снижается уровень тромбоцитов. Развиваются тромбозы.
Слабые ушибы провоцируют масштабные подкожные кровоизлияния. Кровь плохо сворачивается. Носовые кровотечения и кровоточивость слизистых возникают внезапно и часто.Для кровотечений внутренних органов характерны рвота с включениями крови и чёрный стул.
Иммунологический аспект представлен покраснением, зудом и нагноением ран после инъекций и порезов. К раку присоединяются микозы, вирусы и бактерии, активно поражающие здоровье человека.
Может уменьшаться объём лёгких вследствие увеличения лимфатических узлов.
При этом больной ощущает одышку, не может вдохнуть полной грудью, кожные покровы становятся с голубым оттенком, синеют губы, появляется утомляемость и другие признаки кислородного голодания.
Способы определения диагноза
Диагностика подразумевает проведение комплекса лабораторно-инструментальных исследований. Важны показатели формулы крови и миелограммы.
- Развернутый анализ крови показывает уменьшение гемоглобина в 2 раза от нормы. Показатели снижаются при значительных кровопотерях, поэтому не всегда связываются с лейкозами.
- Число эритроцитов и тромбоцитов в сыворотке крови уменьшается в 2-4 раза.
- Снижается количество предшественников эритроцитов.
- Лимфоцит может потерять способность к делению или наоборот ускоренно размножаться. Показатели не будут в норме при лейкозе.
- Базофильные и эозинофильные клетки отсутствуют.
- Скорость оседания эритроцитов увеличивается в 5-10 раз.
- Для лейкоцитов характерен незрелый вид.
При лейкозе миелограмма показывает увеличенное количество бластов.
Для уточнения диагноза и диагностики внутренних органов проводят ультразвуковое исследование органов брюшной полости, эхокардиографию, рентген грудины и биопсию ликвора.
С помощью биохимического исследования крови определяют работоспособность и состояние печени с почками.
К методам диагностики острой онкологической патологии крови относятся магнитно-резонансная и компьютерная томографии. Они актуальны для выявления вторичных очагов. Способ исследований позволяет просканировать все участки человеческого тела.
Лечебная тактика
Лечением занимаются врачи в онкогематологическом центре. Протокол лечения подбирается индивидуально. Зависит от симптомов, стадии рака, состояния больного.
Первый этап в выздоровлении занимает химиотерапия. Препараты вводят внутривенно, реже внутримышечно или перорально.
Компоненты цитостатиков проникают в структуру злокачественных клеток, блокируют размножение и развитие.
Клинические рекомендации включают комплексное использование химиопрепаратов для достижения максимального эффекта. Люди с положительной динамикой выздоровления быстро входят в ремиссию.
При поражении головного или костного мозга используют лечение ионизирующим излучением. Лучевая терапия снимает болевой синдром и убивает аномальные лейкоциты.
В тяжёлых случаях пациентам необходима пересадка костного мозга. Операцию проводят после уничтожения собственного кроветворного органа путём ударных доз химиотерапии. После процедуры выживаемость пациентов возрастает. Метод имеет противопоказания и побочные эффекты:
- Донорский материал тяжело найти.
- Для проведения трансплантации уничтожается иммунитет пациента. В это время человек особо подвержен патогенным бактериям. ОРВИ и другие простые заболевания становятся причиной летального исхода.
- Трансплантируемый материал может не прижиться или начать отвергать организм пациента, распознавая все клетки и органы как чужеродные.
- Операция противопоказана больным с патологиями сердечно-сосудистой системы и почечной недостаточностью.
При достижении положительных результатов пациент отправляется на домашнее лечение. Долгое время ребёнок принимает слабые химиопрепараты для окончательного уничтожения злокачественного процесса.
Прогноз на жизнь
Современные методы диагностики и лечения увеличили шансы на выживаемость среди пациентов. 90% больных острым лимфобластным лейкозом проживают 5 лет со дня определения диагноза. Затем они снимаются с онкологического учёта и считаются здоровыми.
Шансы снижаются при отрицательной реакции на химиотерапию и при высоком уровне лейкоцитов на момент начала лечения болезни.
Каждый седьмой пациент встречается с возникновением рецидива в течение 3 лет после химиотерапии. Вторичное лечение рака эффективно у половины онкобольных.
При хороших жизненных показателях лейкоз может спонтанно ухудшить состояние пациента. При обнаружении подозрительных симптомов необходима срочная диагностика и лечение.Как распознать лейкоз по анализу крови?

Врач-гематолог, доктор медицинских наук Сергей Семочкин про острый лимфобластный лейкоз
Врач-гематолог, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова Минздрава России, доктор медицинских наук Сергей Семочкин рассказал: можно ли распознать острый лимфобластный лейкоз (ОЛЛ) на ранней стадии и поставить диагноз по анализу крови; объяснил, как лечат ОЛЛ и кому показана трансплантация костного мозга (ТКМ).
Каковы ранние симптомы острого лимфобластного лейкоза? Можно ли их увидеть и распознать ОЛЛ?
В данном случае все достаточно просто, потому что слово «острый» означает, что заболевание внезапное и зачастую симптомы очень выразительные. Самый частый симптом — это лихорадка, т.е. повышение температуры тела.
Лихорадка может быть как субфебрильной, так и ярко выраженной, до 39 градусов. Появятся изменения, связанные с поражением костного мозга. Снижение гемоглобина приведет к слабости и быстрой утомляемости.
Могут увеличиться лимфатические узлы, появиться дискомфорт в брюшной полости за счет того, что увеличиваются размеры печени и селезенки. Могут быть проявления кровоточивости — даже во время чистки зубов.
У некоторых пациентов ОЛЛ может начаться с неврологических проявлений – головных болей, головокружения и прочих проблем. Симптоматика обширная, но в данном случае она является достаточно острой, внезапно возникшей.
Смотрите видео на нашем сайте.
Можно ли поставить диагноз по анализу крови? Что он покажет?
Как правило, в анализе крови есть ярко выраженные показатели: изменены ростки кроветворения, количество лейкоцитов выходит за пределы нормы — может упасть ниже нормальных значений, а может стать запредельно огромным. Мне встречались пациенты, у которых количество лейкоцитов при норме от 4 до 9 тысяч повышалось до 200 тысяч на мкл.
Тромбоциты тоже в ряде случаев очень сильно снижены, но главное – изменение количества лейкоцитов. Очень важным маркером является выход опухолевых клеток в кровь, когда в крови появляются незрелые ранние клетки, которые называют бластными.
Если в анализе крови выявили бластные клетки, то это, скорее всего, либо острый лейкоз, либо миелодиспластический синдром.
Как пациент попадает к гематологу?
Анализ крови с характерными изменениями — повод для немедленного вызова скорой помощи и госпитализации пациента в профильный стационар. При лечении детей и подростков у онкогематолога, как правило, есть один-два дня ни диагностику, лечение необходимо начинать, как можно раньше.
В диагностику входит повторный анализ крови, затем – верификация диагноза, для которой проводят биопсию костного мозга. У маленьких детей ее проводят под общей анестезией, у взрослых — под местной. С помощь небольшой иглы делаю прокол грудины или подвздошной кости. У детей пункцию грудины не делают.
Полученный образец костного мозга, который выглядит как обычная пробирка с кровью, отправят в лабораторию, где для подтверждения диагноза проведут целый спектр исследований. Главный критерий – увеличение количества бластных клеток. Только по внешнему виду и по количеству бластных клеток определить вариант лейкоза – невозможно.
Еще в 1913 году установили, что есть лимфоидный, а есть миелоидный вариант лейкоза. Для верификации применяются специальные лабораторные методы: иммунологические и химические. Существует специальный прибор – проточный цитометр, с помощью которого определяют маркеры, характеризующие данный тип клеток.Для определения подвида острого лейкоза, применяют целый спектр генетических исследований, чтобы выйти на более целевую терапию у этих пациентов.
Каковы причины возникновения ОЛЛ? Существует мнение, что этот вид лейкоза очень сильно взаимосвязан с экологическими проблемами, передается по наследству и часто возникает у тех, кто уже переболел каким-то онкологическим заболеванием. Правда это или нет?
Истинную причину возникновения лейкоза у взрослых можно выявить только в 5% случаев, в 95% совершенно непонятно, что там к чему привело. У детей все несколько интересней.
Как возникает лейкоз? В генетическом материале клетки возникает некая первичная мутация, которая сама по себе далеко не всегда приводит к лейкозу.
В дальнейшем к этой мутации присоединяются другие, и когда болезнь все же возникает, в клетке накоплено уже много молекулярных событий, сочетание которых привело возникновению заболевания.
Пик острого лимфобластного лейкоза приходится на детей от двух до четырех лет, потом заболеваемость падает. Следующий пик приходится на 18-29 лет, потом снова спад. После 60 лет — опять небольшой рост.
У части детей раннего возраста прослеживается некая врожденная составляющая этой проблемы. Встречаются случаи ОЛЛ у плода или новорожденного, когда ребенок рождается уже с заболеванием, либо заболевает в течение первого года жизни. Исследования пуповинной крови показали, что у новорожденных встречаются лейкемические поломки, врожденные мутации, которые могут привести к возникновению лейкоза.
И мутацию эту вызывает наследственный фактор, сработавший во время внутриутробного развития. По разным данным, общее количество таких младенцев составляет от 1 до 5%. Дальше многое зависит от инфекционной обстановки, сложившейся вокруг ребенка. Многочисленные инфекции, перенесенные в детстве, способствуют формированию нормальной иммунной системы, которая нейтрализует наследственный фактор.
Если говорить про экологические проблемы, то с ними четкой связи не выявлено.
Влияет ли УФ-излучение, СВЧ, солнечные лучи, радиация?
В Хиросиме и Нагасаки повышенная заболеваемость держалась около 12 лет. После Чернобыля у многих пострадала щитовидная железа, но заболеваемость лейкозами не выросла. Все зависит от типа изотопов попавших в окружающую среду. В Фукусиме тоже этого не случилось, потому что концентрация радиоактивных веществ сильно разбавилась морской водой.
Вред ультрафиолета научно доказан только в отношении меланомы. Четкой связи с ОЛЛ нет. Своим бывшим пациентам мы не разрешаем посещать солярий и не рекомендуем загорать, потому что хотя связь и не доказана, совсем исключать этот фактор тоже нельзя.
Если говорить об СВЧ-излучении, домашние микроволновые печи абсолютно безопасны.
Как лечат ОЛЛ? Что ждет пациента?
Концепция лечения ОЛЛ, которая до сих поре лежит в основе протоколов лечения ОЛЛ, была разработана американским педиатром Дональдом Пинкелем еще в 1962 году. Она включает в себя четыре этапа: индукция ремиссии, консолидация, воздействие на центральную нервную систему и длительный этап поддерживающей терапии на протяжении двух-трех лет.
Во всем мире проводится лечение по клиническим протоколам, разработанным в результате кооперированных исследований. Согласно некоторым работам, строгое следование протоколам повышает выживаемость пациентов на 15-20% по сравнению с индивидуализированным лечением. В протоколе прописаны все действия: от первого дня до последнего.
В нем есть указания, как и в какой момент оценивать возникающие осложнение и что с ними делать. В России два центра, активно ведущих такие протоколы. Центр им. Дмитрия Рогачева, где Александр Исаакович Карачунский в течение многих лет, с начала 1990-х, ведет серию протоколов «Москва — Берлин».
Каждые пять лет дизайн протоколов пересматривают, чтобы улучшить лечение отдельных категорий пациентов. уже в течение многих лет с начала 90-х годов серию протоколов Москва-Берлин. Каждые пять лет меняется дизайн протоколов, направленных на улучшение лечения отдельных категорий пациентов.Во взрослой практике — это НМИЦ гематологии, где ведут кооперированные исследования по острому лимфобластному лейкозу у взрослых.
В каких случаях показана трансплантация костного мозга (ткм)?
В отличие от острого миелоидного лейкоза, показаний к аллогенной (от донора) ТКМ меньше. Ее назначают пациентам, которые не достигли ремиссии в указанные протоколом сроки или имеют неблагоприятный цитогенетический вариант заболевания. В детской практике выздоравливают более 90% детей, и примерно 15-20% являются кандидатами для аллогенной ТКМ.
У взрослых процент пациентов нуждающихся в трансплантации несколько выше, за счет того, что генетических операций высокого риска становится намного больше и ответ на стандартное лечение хуже. Когда мы обсуждали хронический миелолейкоз, там фигурировала филадельфийская хромосома — транслокация (9;22). При ОЛЛ это абсолютно негативный фактор прогноза.
У детей такая мутация встречается меньше чем в 5% случаев, у людей старше 50-60 лет примерно половина В-линейных ОЛЛ будет с филадельфийской хромосомой. В отличие от хронического миелолейкоза, применение ингибиторов тирозинкиназы при остром лимфобластном лейкозе не столь успешно. Вот поэтому во взрослой практике ТКМ необходимо проводить примерно 30% пациентов.
Возрастной порог для аллогенной ТКМ — в районе 55 лет, это разумно.
Как часто случаются рецидивы с ОЛЛ?
Если мы говорим про взрослых людей, то рецидивы случаются почти в 40% случаев. Бывают ранние рецидивы, которые случаются прямо на терапии.
В таком случае необходимо менять лечение, делать его более интенсивным и тяжелым. В таких случаях, как правило, показана ТКМ. Поздний рецидив может случиться и через 20 лет.
К сожалению мы не можем убрать причину, которая вызывает это заболевание — оно может вернуться.
Можно ли планировать беременность после ОЛЛ?
Длительная химиотерапия нарушает фертильность, поэтому лучше провести криоконсервацию спермы/яйцеклетки, а еще лучше эмбриона — это более надежный способ. У мужчин, как правило, серьезно нарушается сперматогенез, но у женщин дело обстоит несколько лучше. Вероятность забеременеть и выносить здорового ребенка высока. Если прошло не менее пяти лет в ремиссии, никаких ограничений нет.
Может ли беременность быть провоцирующим фактором для рецидива?
Скорее, нет. Это не такое частое явление, как при некоторых других заболеваниях, где беременность действительно может стать провоцирующим фактором.
Передается ли ОЛЛ по наследству?
Лимфобластный лейкоз – редкое заболевание, поэтому вероятность того, что он случится у ребенка, рожденного от родителей после ОЛЛ, крайне мала.
Как будут лечить ОЛЛ в будущем?
Представляется, что в основе лечения онкологических заболеваний в будущем станет активация собственного иммунитета. Нам необходимо настроить иммунную систему таким образом, чтобы она распознавала и убирала раковые клетки.
Сейчас мы находимся на раннем этапе развития CAR-T-терапии, но через какое-то время технологии настолько усовершенствуются, что, скорее всего, она станет одним из основных методов терапии при целом ряде онкогематологических заболеваний.
Суть метода заключается в том, что у пациента собирают его собственные Т-лимфоциты и отправляют в специальную лабораторию. Эта лаборатория может быть в другом городе, стране — не важно. В лаборатории эти Т-лимфоциты перепрограммируются: в них появляется информация об опухолевых клетках, присутствующих в организме пациента.
После перепрограммирования Т-лимфоциты вводят обратно пациенту, она находят раковые клетки и возникает ремиссия. Основные проблемы – создать качественный процесс распознавания и разработать стандартные протоколы лечения.
Много вопросов возникает в понимания биологии заболевания, потому как каждый конкретный случай весьма индивидуален. Мы знакомы только с грубыми поломками, но каждая отдельная поломка провоцирует различное течение болезни.
Мы уже сейчас можем полностью секвенировать геном опухолевой клетки и главное научиться понимать, что в патогенезе является ключевым и как на это можно воздействовать, тогда мы ближе подойдем к полному излечению болезни.
За этим будущее.
Острый лимфобластный лейкоз
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов.
Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания.
Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»).
Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты относятся к миелоидной линии.
Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей, но это заболевание нередко встречается и во взрослом возрасте.
Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу.Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
Частота встречаемости и факторы риска
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев лейкоза не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
Признаки и симптомы
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации.
Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками.Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка — как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции.
Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации.
Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы — нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
Диагностика
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге.
Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток).
Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.Так, ОЛЛ может быть B-клеточным (около 80% случаев) и T-клеточным, в зависимости от того, относятся ли лейкемические клетки к B- или T-лимфоцитарной линии. В зависимости от «степени зрелости» бластных клеток среди как В-, так и Т-клеточных лейкозов выделяют несколько вариантов; их установление в ходе иммунофенотипирования важно для определения стратегии лечения.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей обычно определяет более высокий риск (худший прогноз) по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни и ухудшается прогноз. Так, особенно неблагоприятна филадельфийская хромосома – транслокация t(9;22). В то же время, например, транслокация t(12;21) связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Лечение
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии.
Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
-
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться такие лекарства, как винкристин, гормоны-глюкокортикостероиды, аспарагиназа, антрациклины (даунорубицин и др.), иногда и другие препараты.
Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ.
-
Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения.
В ходе курсов терапии на этапе консолидации могут использоваться метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.
-
Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – 2-3 года.
На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения.Лекарства принимаются в виде таблеток, пребывание в больнице при этом не требуется.
Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы.
Основной препарат, используемый для интратекального введения при ОЛЛ, — метотрексат; дополнительно также применяются цитарабин и глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы полихимиотерапии, аналогичные используемым при индукции. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный.
В этом случае проводится противорецидивная терапия. Выбор протокола лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным.
К сожалению, при раннем рецидиве шансы на успех терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии.
Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами.Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией.
Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе «обычных» побочных эффектов химиотерапии можно также назвать тошноту, рвоту, облысение.
Серьезнае проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д.
Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата (онкаспар, эрвиназа).
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром.
При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой — чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается.
Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Прогноз
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель.
Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 80% больных детей (некоторые источники приводят и более высокие цифры — например, до 85%).
У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение пяти и более лет, после чего человека можно считать здоровым.
