Анализы на полиморфизмы
Фолатный цикл, полиморфизм генов (MTHFR, MTR, MTRR)

Фолаты – производные фолиевой кислоты (витамина B9), играющие ведущую роль в широком спектре жизненно важных процессов: стимулируют эритропоэз, участвуют в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов, участвуют в обмене холина, гистидина, в метилировании ДНК и РНК, способствуют регенерации мышечной ткани, развитию быстро растущих тканей (кожа, оболочки ЖКТ, костный мозг), выполняют защитную роль при беременности от тератогенных и повреждающих факторов на плод, способствуют созреванию и функционированию плаценты, оказывают эстрогеноподобное действие. Данные функции реализуются в процессе Фолатного цикла – это каскадный процесс синтеза аминокислоты метионина из гомоцистеина, контролируемый 3-мя ферментами: метилентетрагидрофолатредуктазой (MTHFR), метионин-синтазой (MTR) и метионин-синтаза-редуктазой (MTRR). В фолатном цикле фолаты являются коферментами. Главные причины нарушения фолатного цикла: 1. Генетические дефекты ферментов фолатного цикла MTHFR, MTR и MTRR. 2 Дефицит витаминов: фолиевой кислоты, витаминов В6 и В12, участвующих в обмене фолатов. Генетические дефекты ферментов приводят к снижению их функциональной активности, нарушению фолатного цикла, накоплению гомоцистеина в клетках и повышению уровня гомоцистеина в плазме крови, который оказывает выраженное тромбофилическое, токсическое, атерогенное действие и обусловливает повышенный риск развития ряда патологических процессов: * Осложнения беременности (фетоплацентарная недостаточность, преждевременная отслойка нормально расположенной плаценты, поздний гестоз) * Пренатальная смерть и дефекты развития плода (незаращение нервной трубки, анэнцефалии, деформации лицевого скелета) * Сердечно-сосудистые заболевания (ишемическая болезнь сердца, атеросклероз, инфаркт миокарда, тромбозы) * Канцерогенез (колоректальная аденома, рак молочной железы и яичника) и усиление побочных эффектов при химиотерапии * Эктопия хрусталика * Остеопороз
Показания для назначения
1. Акушерская патология: привычное невынашивание, антенатальная гибель плода, поздние гестозы, преждевременная отслойка плаценты, неудачные попытки ЭКО, синдром задержки внутриутробного развития плода, рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта.
2.
Плановая подготовка к беременности при отягощенной наследственности (с акушерской патологией и сосудистым тромбозом в анамнезе, наличие родственников первой степени родства с наследственной тромбофилией и сердечно-сосудистыми катастрофами, особенно в раннем возрасте и др.)
3.
В гинекологии: планирование или применение гормональной контрацепции, гормональной заместительной терапии у женщин, имеющих тромбозы в анамнезе и/или родственников первой степени родства с наследственной тромбофилией и тромбоэмболическими осложнениями, при планировании гинекологических операций.
4.
5. Сердечно-сосудистые заболевания: ишемическая болезнь сердца, артериальная гипертензия, атеросклероз и др.
6.
Ситуации высокого риска: повышенный уровень гомоцистеина в крови (гипергомоцистеинемия), массивные хирургические вмешательства — перед трансплантацией, эндопротезированием и др., длительная иммобилизация, семейная предрасположенность к онкологическим заболеваниям и назначение химиотерапии.
Маркер
Маркер генетических мутаций фолатного цикла.
Клиническая значимость
Исследование Полиморфизм генов Фолатного цикла (MTHFR, MTR, MTRR) проводится для диагностики причины и риска развития тромбофилии, связанной с нарушением обмена фолиевой кислоты и гипергомоцистеинемией.
Анализ полиморфизмов в генах фолатного цикла позволяет определить предрасположенность к опасным для жизни заболеваниям, связанным с нарушением обмена фолиевой кислоты, гипергомоцистеинемией и дает возможность своевременно назначить корректирующую терапию
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Биологический материал
Условия доставки
Контейнер
Объем
Цельная кровь
Условия доставки:
24 Час. при температуре от 2 до 8 градусов Цельсия
Контейнер:
Система с ЭДТА без разделительного геля
Стандартные условия: утром до 11.00, натощак, через 8-12 часов периода голодания. Особой подготовки не требуется. Важно: !!!Не курить в течение 30 минут до сдачи крови.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружена.
- Не обнаружена.
Интерпретация:
- Генетическое исследование выявляет в определенном участке ДНК замену нуклеотида, приводящее к замене аминокислотного состава белка и соответственно изменению биохимических свойств фермента.В результате нуклеотидных замен в кодирующем гене фермента снижается его функциональная активность.
Выявляют несколько вариантов генотипа (сочетание аллелей гена), влияющих на изменение функции кодируемого им фермента: аллель «нейтральный» – нормальная активность фермента, «гетерозигота по мутантному аллелю» — сниженная активность фермента, «гомозигота по мутантному аллелю» — значительно сниженная активность фермента.
Сниженная активность фермента приводит к нарушению метаболического пути превращения гомоцистеина, увеличению его содержание в плазме крови (гипергомоцистеинемии) и вероятности развития патологических состояний.
Образец результата (PDF)
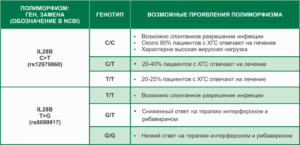
Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)

array(20) { [«catalog_code»]=> string(6) «180016» [«name»]=> string(189) «Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3071» [«url»]=> string(56) «folatnyj-cikl-issledovanije-polimorfizmov-v-genah_180016» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
» [«opisanie»]=> string(10991) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Исследование полиморфизмов в генах:
- MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133
- MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131
- MTR (метионинсинтаза, D919G, A>G), rs1805087
- MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394
- SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266
В данной панели исследуются факторы свертывающей системы крови, ассоциированные с дефектами ферментов фолатного цикла, которые в свою очередь влияют на состояние стенок сосудов, впоследствии приводящие к тромбофлебическим состояниям.
Генетические дефекты ферментов фолатного цикла (MTHFR, MTR, MTRR) особенно в сочетании с дефицитом в организме фолиевой кислоты и витаминов В6 и В12 приводят к нарушению фолатного цикла, что в свою очередь влечет за собой накопление гомоцистеина в клетках и повышение его уровня в плазме.
Гомоцистеин обладает тромбофилическим действием, а также выраженным токсическим и атерогенным действием, что повышает риск развития ряда патологических процессов, таких как усиление побочных эффектов при проведении химиотерапии и повышение риска возникновения сердечнососудистых заболеваний (ишемическая болезнь сердца, инфаркт миокарда, атеросклероз, венозные тромбозы).
Дефицит в организме витаминов В6 и В12 усиливает негативный эффект полиморфизмов в генах фолатного цикла.
Ген SLC19A1 является транспортером фолатов. Участвует также в поддержании внутриклеточной концентрации фолатов. Мутации в этом гене связаны с дефектами нервной трубки и расщелиной губы и/или неба у плода во время беременности. Мутации в гене влияют на возникновение побочных эффектов при терапии метотрексатом.
Определение нуклеотидной последовательности соответствующих генетических локусов проводится методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Преимущества метода:
- высокая прогностическая значимость выявляемых факторов риска;
- точность определения генотипа;
- анализ на наличие мутаций достаточно провести 1 раз в жизни.
Показания к исследованию:
- Гипергомоцистеинемия (повышенный уровень гомоцистеина в крови);
- Планирование беременности;
- Невынашивание беременности, гибель плода во 2 и 3 триместрах беременности;
- Рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта;
- Ишемическая болезнь сердца, артериальная гипертензия, атеросклероз, венозный тромбоз;
- Тромбоэмболии;
- Антифосфолипидный синдром;
- Семейная предрасположенность к онкологическим заболеваниям;
- Назначение химиотерапии;
- Назначение оральных контрацептивов и гормональной заместительной терапии.
Интерпретация результатов:
Для каждого полиморфизма в бланке ответа в графе «Результат» указывается его аллельное состояние: «Гетерозигота» или «Гомозигота».
Пример результата исследования. Выявление полиморфизмов в генах, связанных с фолатным циклом
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | CT |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131 | AC |
| Полиморфизм в гене MTR (метионинсинтаза, D919G, A>G), rs1805087 | AG |
| Полиморфизм в гене MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394 | AG |
| Полиморфизм в гене SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266 | AA |
Полиморфизмы генов фолатного цикла и беременность

Как только у женщины появляются мысли стать мамой, то она обращается в женскую консультацию для полного обследования. И в первую очередь врач назначает фолиевую кислоту. Насколько важна роль этого витамина для организма, что такое фолатный цикл и в чем заключается опасность при полиморфизме генов?
Для начала разберемся, что такое полиморфизм генов. Гены у разных людей похожи, но имеют небольшие нюансы, которые и отличают нас друг от друга. Эти нюансы, различия и называются полиморфизмами.
Причиной полиморфизма генов являются изменения отдельных участков в молекуле ДНК, что приводит к изменению свойств гена (иногда в лучшую, а иногда — в худшую сторону). Некоторые изменения ведут к генетическим заболеваниям, другие не влекут за собой болезни, но являются фактором предрасположенности к ряду патологий.
А что же такое фолатный цикл? Фолатный цикл – это совокупность процессов, в результате которых при помощи ферментов и коферментов из гомоцистеина появляется незаменимая аминокислота метионин.
Ферменты — это вещества, ускоряющие биохимические процессы в организме. В фолатном цикле принимают участие 3 фермента:
- метилентетрагидрофолатредуктаза MTHFR (для перевода фолиевой кислоты в активную форму);
- метионин-синтаза-редуктаза MTRR (влияет на активность метионин-синтазы);
- метионин-синтаза MTR (осуществляет превращение гомоцистеина);
Коферменты — это производные витаминов, необходимые для функционирования ферментов.
Коферментами являются фолаты, а для обмена фолатов необходимы витамины:
- В9 (фолиевая кислота);
- В6 (пиридоксин);
- В12 (цианокобаламин).
Фолатный цикл обеспечивает нормальное функционирование органов и систем. При мутации в генах происходит замена одного нуклеотида на другой, изменения числа повторяющихся фрагментов ДНК. Это все ведет к изменению биохимических свойств фермента и его функции, в результате чего нарушается превращение гомоцистеина в метионин.
Сбой в фолатном цикле влечет за собой увеличение концентрации в крови гомоцистеина, оказывающего на организм токсическое, атерогенное и тромбофиличское действие. Иными словами, возрастает риск некоторых осложнений беременности (например, гестоза или отслоения плаценты) и возникновения дефектов у плода.
Из-за чего может нарушиться метаболизм гомоцистеина и произойти сбой в фолатном цикле?
- генетические дефекты ферментов;
- дефицит витаминов вследствие недостаточного поступления с пищей или на фоне приема лекарственных средств (эстрогенсодержащих оральных контрацептивов, цитостатиков, противоэпилептических средств).
Кроме того, повышенный уровень гомоцистеина может быть при хронических заболеваниях: почечной недостаточности, анемии, псориазе, гипотиреозе; злокачественных опухолях яичников, молочной и поджелудочной желез.
Информация о ферментах фолатного цикла (MTHFR, MTRR, MTR) содержится в генах, которые именуются генами фолатного цикла. Эти гены могут иметь свои особенности у каждого человека — полиморфизмы. Исследование полиморфизмов в таких генах способно выявить, есть ли в конкретном случае риск нарушения фолатного цикла.
Важно! Не все полиморфизмы в генах фолатного цикла могут приводить к повышению гомоцистеина.
Диагностика полиморфизмов генов фолатного цикла
Исследование на полиморфизм генов фолатного цикла проводят методом полимеразной цепной реакции. Кровь для анализа лучше сдавать утром натощак, последний прием пищи должен быть накануне вечером.
Расшифровку данных полиморфизма генов фолатного цикла (MTR, MTRR, MTHFR) проводит только врач. Даже при выявленном полиморфизме не надо отчаиваться — это говорит только о предрасположенности к заболеванию и не означает, что в течение беременности обязательно будут осложнения.
Полиморфизмы генов фолатного цикла: в чем риск для матери и плода?
Уровень гомоцистеина при нормально протекающей беременности чуть понижается, составляя 4,6-12,4 мкмоль/л, и восстанавливается только после родов. Но при нарушениях в фолатном цикле он повышается и может оказывать токсическое, тромбофилическое и атерогенное действие.
Все это приводит к развитию различных патологических процессов со стороны матери и плода:
- угроза прерывания беременности;
- неудачное ЭКО;
- неразвивающаяся беременность;
- фетоплацентарная недостаточность;
- хроническая внутриутробная гипоксия плода;
- поздний гестоз;
- внутриутробная задержка роста и развития плода;
- пороки развития плода (дефекты нервной трубки, деформация лицевого скелета с незаращением неба и верхней губы, анэнцефалия);
- повышается риск развития синдрома Дауна.
Планирование беременности при полиморфизмах генов фолатного цикла
При планировании беременности важно выявить возможные хромосомные аномалии, в том числе носительство полиморфизма генов гемостаза и фолатного цикла.
Чтобы исключить наличие какой-либо патологии, обязательно надо посетить акушера-гинеколога. При опросе врач досконально соберет анамнез и при необходимости назначит дополнительное обследование, консультацию генетика.
Уровень гомоцистеина проверяют, если:
- предыдущие беременности завершились неблагоприятным исходом;
- у женщины повышенная свертываемость крови;
- у родственников будущей мамы были тромбозы, инфаркты или инсульты до 50 лет.
Важно! В течение 2-3 месяцев до зачатия всем женщинам совместно с партнером рекомендуют пропить фолиевую кислоту в профилактической дозе 0,4 мг/сутки.
Ведение беременности при полиморфизмах генов фолатного цикла
При наступлении беременности фолиевую кислоту продолжают пить до 12 недель включительно, что обеспечивает снижение риска нарушений со стороны нервной системы плода. Витамин выпускается в таблетках по 1 мг, назначают по 1 таб/сутки.
При полиморфизме дозировка может увеличиваться до 5 мг/сутки, а прием продолжают в течение всей беременности совместно с витаминами группы В. В критические сроки проводят дополнительную терапию.
Врач-генетик может порекомендовать принимать не обычный В9, а фолиевую кислоту в активной форме.
В чем разница? Дело в том, что в чистом виде фолиевая кислота организмом не усваивается — для этого она должна преобразоваться в определенную форму — метилфолат.
При мутации некоторых генов процесс превращения В9 в усвояемую форму нарушен, поэтому обычная фолиевая кислота усваивается плохо. В этом случае препаратом выбора становится ее активная форма — L-метилфолат, который легко всасывается в кровь без каких-либо преобразований.
Рекомендуют употреблять больше пищи с витамином В9 – шпинат, брокколи, горошек, авокадо, банан, арахис, бобовые, белый рис, хлеб из муки грубого помола, печень, мёд, томатный и апельсиновый соки.
В обязательном порядке контролируют уровень гомоцистеина в динамике, коагулограмму.
Врач-гинеколог о гомоцистеине при планировании беременности.
Роды при полиморфизмах генов фолатного цикла
В большинстве случаев на фоне профилактических мероприятий и проводимой терапии роды проходят хорошо.
Но могут быть следующие осложнения:
- преждевременные роды;
- преэклампсия, когда показано оперативное вмешательство в экстренном порядке;
- преждевременная отслойка нормально расположенной плаценты;
- кровотечение.
Главное, не переживайте и соблюдайте все рекомендации.
В послеродовом периоде до окончания кормления грудью продолжайте прием фолиевой кислоты по 0,4-1 мг/сутки.
Владлена Размерица, акушер-гинеколог, специально для Mirmam.pro
Полиморфизм — что это? Генетический полиморфизм
Генетический полиморфизм являет собой состояние, при котором отмечается явное разнообразие генов, но несмотря на это частота наименее распространённого гена в популяции будет составлять более 1% Поддержание полиморфизма происходит благодаря постоянного пере-комбинирования и мутирования генов. Согласно результатам последних исследований, проведённых учеными-генетиками, генетический полиморфизм имеет весьма широкую распространённость, ведь комбинирование гена может доходить до нескольких миллионов.
Мутирование генов
ДНК. vchal/shutterstock
В реальной современной жизни гены являются не такими постоянными, однажды и на всю жизнь. Гены могут мутировать с различной переодичностью. Что, в свою очередь, может становиться причиной появления каких-либо ранее не имевшихся признаков, которые бывают далеко не всегда полезны.
Все мутации принято подразделять на следующие виды:
- генные – приводящие к переменам последовательности нуклеотидов ДНК в каком-либо отдельном гене, что приводит к изменениям также и в РНК и в белке, кодируемом данным геном. Генные мутирования также подразделяются на 2 категории рецессивные и доминантными. Данный вид мутаций может привести к развитию новых признаков, поддерживающих либо подавляющих жизнедеятельность живого существа.
- генеративное мутирование отражается на половых клетках и передаются при сексуальном контакте;
- соматическое мутирование не отражается на половых клетках, у животных и людей не передаётся от родителей к детям, а у растений может наследоваться в случае вегетативного размножении;
- геномное мутирование отражается на изменении численности хромосом в клеточном кариотипе;
- хромосомное мутирование напрямую затрагивает процесс перестройки структурности хромосом, изменения положений их участков, происходящих из-за разрывов либо выпадением отдельных участков.
К мутированию генов, а, значит, и к повышению распространённости недугов имеющих наследственную природу могут привести следующие составляющие современной жизни:
- Техногенные катастрофические происшествия;
- Загрязнение экологической среды (применение пестицидов, добыча и использование горючего, применение средств бытовой химии);
- Использование лекарственных средств и пищевых добавок, воздействующих на ДНК и РНК;
- Приём в пищу генетически преобразованных продуктов питания;
- Длительное, постоянное, либо особенно сильное кратковременное радиационное излучение.
Мутирование генов – процесс весьма непредсказуемый. Это связано с тем,что заранее предугадать, какой ген, каким образом и в какую сторону мутирует – предугадать практически невозможно.
Мутирование генов протекает сам по себе, изменяя наследственные факторы и, на примере такого генетически обусловленного заболевания как тромбофилия, вполне очевидно, что далеко не всегда эти преобразования идут на пользу.
Виды полиморфизма
хромосомы. Rost9/shutterstock
Среди учёных-генетиков принято различать преходящий и сбалансированный генный полиморфизм. Преходящий полиморфизм отмечается в популяции в том случае, если имеет место замена аллеля, бывшего ранее обыкновенным, иными аллелями, наделяющими своих носителей более высоким уровнем приспособленности.
В процессе протекания преходящего полиморфизма отмечается направленное сдвигание (исчисляется в %) различных генотипных форм. Данный вид генного полиморфизма — являет собою основной путь эволюционного процесса. В качестве примера преходящего полиморфизма можно привести процесс индустриального механизма.
Таким образом, в результате ухудшения экологического состояния в ряде крупнейших мегаполисов мира более чем у 80-ти разновидностей бабочек, появились более темные расцветки. Это произошло по причине постоянного загрязнения стволов деревьев и последующего уничтожения более светлых особей бабочек насекомоядными птицами.Позже выяснилось, что более темная расцветка тела у бабочек появилась по причине генного мутирования, вызванного загрязнением окружающей среды.
Сбалансированный генный полиморфизм объясняется отсутствием сдвига численного соотношения различных форм и генотипов среди популяций, проживающих в не изменяющихся условиях окружающей среды.
Однако процентное соотношение форм либо остается неизменным, либо может варьироваться вокруг какой-либо не изменяющейся величины.
В отличие от преходящего генного полиморфизма, сбалансированные полиморфические явления — это неотъемлемая часть непрекращающегося эволюционного процесса.
Генный полиморфизм и состояние здоровья
современный человек. chombosan/shutterstock
Современные медицинские исследования доказали, что процесс внутриутробного развития ребёнка может значительно увеличивать вероятность тромбогенных сдвигов.
Особенно это ожидаемо в том случае, если женщина имеет предрасположенность либо страдает сама генетическим заболеванием.
Чтобы беременность и процесс рождения долгожданного малыша проходили без серьёзных осложнений, врачи рекомендуют поднять свою родословную на предмет того, страдали ли близкие или более дальние родственники будущей мамы наследственно обусловленными заболеваниями.
На сегодняшний день стало известно, что гены такого передающегося по наследству заболевания как тромбофилия, способствуют развитию тромбофлебита и тромбоза во время вынашивания ребёнка, родовой деятельности и послеродового периода.
Кроме того полиморфические изменения генов фактора протромбина FII могут стать причиной неизлечимого бесплодия, развитию наследственно обусловленных пороков развития и даже внутриутробной гибели младенца ещё до рождения либо вскоре после рождения. Кроме того, данное генное преобразование в разы увеличивает риск развития таких недугов, как: тромбофлебит, тромбоэмболия, атеросклероз, тромбоз, инфаркт миокарда и ишемическое поражение сосудов сердца.
Генный полиморфизм фактора Лейдена FV также может значительно усложнить процесс беременности, так как он способен провоцировать привычный выкидыш и способствовать развитию генетических нарушений у ещё нерождённого ребёнка. Кроме того, он может вызвать наступление инфаркта либо инсульта в юном возрасте либо способствовать развитию тромбоэмболии;
Мутирование генов PAI-1 уменьшает активность противостоящей свертыванию системы, по этой причине его принято считать одним из важнейших факторов нормального протекания процесса свёртывания крови.Развитие таких недугов как тромбоз либо тромбоэмболия – весьма опасны при беременности. Без профессионального медицинского вмешательства они нередко приводят к смертности во время родов как матери, так и ребёнка. Кроме того, роды при наличии этих недугов в большинстве случаев бывают преждевременными.
Когда необходимо сдавать кровь с целью выявления генетических нарушений?
Сдача анализов. Alexander Raths/shutterstock
Иметь некоторые сведения о предрасположенности к тем или иным генетическим заболеваниям рекомендуется каждому человеку даже если он не планирует беременность.
Подобные знания могут оказать бесценную помощь в профилактике и лечении ускоренного тромбобразования, инфарктов, инсультов, ТЭЛА и других недугов.
Однако на сегодняшний день значение информации о своём генетическом фонде играет огромную роль в лечении кардиологических недугов и в акушерском деле.
Таким образом, где назначение анализа на выявление тромбофилии и гемофилии играет особую роль в следующих случаях:
- При планировании беременности;
- При наличии патологических осложнений во время беременности;
- Лечении заболеваний сосудов, сердца, артерий и вен;
- Выяснении причин выкидышей;
- Лечении бесплодия;
- При подготовке к плановым операциям;
- В лечении онкологических новообразований;
- При лечении гормональных нарушений;
- Лицам, страдающим ожирением;
- При лечении эндокринологических болезней;
- При необходимости принимать контрацептивные составы;
- Лицам, занимающимся особенно тяжёлым физическим трудом и пр.
Своевременное развитие медицины позволяет заблаговременно выявить генетические аномалии, определить их полиморфизм и возможную предрасположенность к развитию генетических заболеваний путем проведения сложнейшего анализа крови.
Хотя при проведении данного анализа в платных медицинских центрах подобное обследование может требовать некоторых затрат, проведение такого анализа может весьма облегчить лечение либо предупредить развитие множества генетических нарушений.
2019-07-10 01:07:40
- Остеохондроз — коварное заболевание, при котором поражаются хрящевые и в более поздних стадиях — костные элементы позвоночника. С возрастом
- Никто из исследователей не принимал во внимание того факта, что рефракция глаза не является постоянным состоянием, что она непрерывно
- Мы уже говорили, что беременность является естественным состоянием женщины. С началом беременности в организме женщины происходит ряд физиологических изменений
- Атеросклероз — это заболевание кровеносных сосудов, при котором на их стенках происходит отложение холестерина, солей кальция, разрастается соединительная
- Общим называется такой массаж, при котором массируется только тело. Массаж головы в общий массаж не входит. Эффективность общего
- Почечная недостаточность — нарушение функции почек, при которой наблюдаются резкое уменьшение количества выделяемой мочи, накопление в крови токсических продуктов
Анализы в KDL. Генетический риск нарушений системы свертывания
Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови. Тромбофилия – это повышенная склонность к случайному (без видимых причин) тромбозу глубоких вен и тромбоэмболическим осложнениям.
Тромбоз может возникнуть при нарушениях кровообращения (застой крови), повышенной способности крови образовывать тромбы (гиперкоагуляции), повреждениях сосудистой стенки и при сочетании этих факторов.
Гиперкоагуляция может быть обусловлена наличием генетической предрасположенности к тромбофилии (наиболее часто встречаются полиморфизмы в генах F2 и F5), которую позволяет выявить этот анализ.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.
Что именно определяется в процессе анализа?
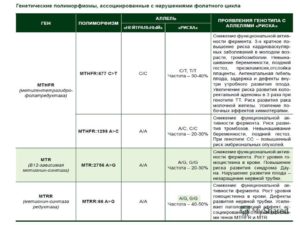
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.
- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории.
В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Сроки выполнения теста
Результат генетического исследования можно получить спустя 10-11 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
Можно сдавать кровь в течение дня, не ранее, чем через 3 часа после приема пищи или утром натощак. Чистую воду можно пить в обычном режиме.
Выдается заключение в виде Генетической карты здоровья
Исследование входит в состав
Не нашли офиса рядом? Закажите услугу «Выезд на дом». подробнее пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00сб: 7:00-17:00
вс: 7:00-15:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00сб: 7:00-17:00
вс: 7:00-15:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00
сб-вс: 7:30-19:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-19:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-19:00сб: 7:30-15:30
вс: 7:30-13:30
пн-пт: 7:00-19:00сб: 7:30-15:30
вс: 7:30-13:30
Кровь на полиморфизм генов тромбофилии
Кровяные сгустки формируются при свертывании крови для восстановления поврежденных сосудов в результате биохимических реакций между специальными клетками (тромбоцитами) и белками (факторами свертываемости), которые ответственны за регуляцию процессов гемореологии и гемостаза. При расстройстве этих процессов тромбы начинают образовываться без видимой причины и блокировать приток крови к окружающим тканям. Такая тенденция к повышенному образованию сгустков крови называется гематогенная тромбофилия.
Если у пациента выявлена тромбофилия, то клинические проявления будут зависеть от места нахождения сгустков, степени нарушения кровообращения, сопутствующей патологии, возраста и пола пациента. Основной симптом — это частое образование тромбов, болезненность в месте их локализации, нарастающая отечность.
Полиморфизм Arg353Gln (10976 G-{amp}gt;A) коагуляционного фактора VII (F7)
Коагуляционный фактор V или фактор V свертывания крови является белковым кофактором при образовании тромбина из протромбина. Полиморфизм G1691A Leiden (аминокислотная замена Arg (R) -{amp}gt; Gln (Q) в позиции 506, известная также как «мутация Лейден» или «Ляйден») является показателем риска развития венозных тромбозов.
Это точечная (однонуклеотидная) мутация гена, кодирующего фактор V свертывания крови, придает устойчивость активной форме фактора V к расщепляющему действию специализированного регулирующего фермента, С-белка, что приводит к гиперкоагуляции. Соответственно, риск образования тромбов повышается. Распространенность мутации в популяциях европейского типа составляет 2-6%.
Риск тромбозов глубоких вен (TГВ): в 7 раз выше у гетерозиготных носителей Лейденской мутации гена F5 Arg506Gln и в 80 раз выше у гомозигот.
– Использование пероральных контрацептивов дополнительно повышает риск развития ТГВ в 30 раз у гетерозигот, в 100 раз при гомозиготном носительстве.
– Беременность – в 16 раз повышает риск ТГВ.
– Гормонзаместительная терапия – в 2-4 раза увеличивает риски.
– Катетеризация центральных вен повышает риск ТГВ в 2-3 раза
– Хирургические вмешательства – в 13 раз.
– Инфекционные и онкологические заболевания также повышают риск развития ТГВ. Риск развития ишемического инсульта у женщин в возрасте 18-49 лет при наличии Лейденской мутации возрастает в 2,6 раза, а на фоне приёма пероральных контрацептивов увеличивается в 11,2 раза.
Показания к анализу
- Венозный тромбоз,
- развитие тромбоэмболических заболеваний в молодом возрасте;
- рецидивирующий характер тромбоэмболизмов;
- сердечно-сосудистые заболевания в семейном анамнезе,
- заместительная гормонотерапия,
- прием гормональных контрацептивов,
- невынашивание беременности,
- фетоплацентарная недостаточность,
- внутриутробная гибель плода,
- токсикоз,
- задержка развития плода,
- отслойка плаценты,
- пациентам, готовящимся к большим полостным операциям (миома матки, кесарево сечение, кисты яичников и пр.).
Клинические данные
– выкидыш на ранних сроках (риск повышается в 3 раза),
– отставания развития плода,
– позднего токсикоза (гестоза),
– фетоплацентарной недостаточности.
Повышенная склонность к тромбообразованию может приводить к артериальным тромбоэмболиям, инфаркту миокарда и инсульту. Наличие мутации Лейден повышает риск первичных и рецидивирующих венозных тромбозов, по крайней мере, в 3-6 раз.
Приводимые ниже примеры иллюстрируют связь мутации с различными видами тромбозов и другими кардиоваскулярными заболеваниями.
https://www.youtube.com/watch?v=bhCF6JMeQIc
В течение 8 лет в нескольких центрах проводилось исследование более 300 пациентов с венозной тромбоэмболией (ВТЭ), в ходе которого был установлен повышенный 3,7-кратный риск ВТЭ при наличии мутации Лейден. В другой работе пациенты с венозной тромбоэмболией исследовались в течение 68 месяцев. За это время 14% пациентов перенесли рецидив ВТЭ.
Мутация Лейден фактора V приводит к четырехкратному увеличению риска повторного ВТЭ. Для пациентов с ВТЭ, имеющим мутацию Лейден, рекомендована более длительная антикоагуляционная терапия по сравнению с пациентами с нормальным фактором V.
Следует отметить, что риск развития венозных тромбозов значительно увеличивается (8-кратное увеличение), если пациент, кроме мутации Лейден фактора V, также имеет мутацию Т полиморфизма С677Т гена метилтетрагидрофолатредуктазы.
Одним из самых опасных осложнений гормональных контрацептивов являются тромбозы и тромбоэмболии. Многие женщины с такими осложнениями являются гетерозиготными носителями мутации Лейден (генотип G/A). На фоне приема гормональных контрацептивов риск тромбозов у них повышен в 6-9 раз.У женщин, использующих гормональные противозачаточные средства и имеющих гомозиготную мутацию Лейден (генотип A/A), риск развития тромбоза церебральных синусов (ТЦС) повышен более чем в 30 раз по сравнению с пациентками, не имеющих этой мутации.
Были обобщены конечные данные исследования «Women’s Health Initiative Estrogen Plus Progestin» о частоте венозных тромбозов на фоне заместительной гормонотерапии (ЗГТ). В исследовании приняли участие 16 608 женщин в постменопаузе в возрасте от 50 до 79 лет, наблюдавшихся с 1993 по 1998 гг. в течение 5 лет.
Присутствие других генетических мутаций (протромбин 20210А, метилентетрагидрофолатредуктаза С677Т, фактор XIII Val34Leu, PAI-1 4G/5G, фактор V HR2) не влияли на связь ЗГТ и риска венозных тромбозов. Анализ более десяти независимых исследований показал, что среди пациентов, перенесших инфаркт миокарда до 55 лет, распространенность мутации Лейден была заметно выше.
Среднестатистический риск развития инфаркта миокарда увеличивается в 1,5 раза. Более того, мутация Лейден приводит к 2,8 – кратному повышению количества пациентов без выраженного коронарного стеноза, заболевших инфарктом миокарда.
Виды заболевания
Генетический дефект обуславливает образование большого количества кровяных сгустков у молодых людей.
Основные признаки — возникновение множественных тромбозов у относительно молодых людей без видимых причин.
Наследственная тромбофилия обусловлена генетическими дефектами, которые присутствуют с самого рождения. Наибольшая предрасположенность к врожденной форме появляется, когда оба родителя — носители дефектных генов.
Чаще всего встречаются следующие аномалии:
- дефицит антитромбина III и белка C и S, которые отвечают за повышенное образование сгустков;
- фактор V Лейден, препятствующий свободному кровотоку.
Когда необходимы тесты?
Если беременность протекает с осложнениями, то женщине нужно дополнительное обследование.
- повторный тромбоз;
- единичный или множественный тромбоз в сравнительно молодом возрасте;
- планирование беременности;
- возникшие осложнения при вынашивании ребенка;
- онкологические и системные недуги;
- последствия сложных операций, тяжелых ранений, инфекций.
Какие анализы проводятся?
Для исследования берется венозная кровь, которая содержит генетические маркеры тромбофилии, информацию о составе, вязкости, свертываемости. Для этого пациенту проводится коагулограмма — базовый анализ крови на тромбофилию, позволяющий диагностировать проблемы с гемостазом и гемореологией. Он включает определение таких параметров, как:
- время свертывания крови;
- АЧТВ;
- протромбиновый индекс;
- тромбированное время;
- концентрация фибриногена;
- фибринолитическая активность;
- активированное время рекальцификации;
- период лизиса (растворения) эуглобулинового сгустка;
- активность антитромбинов;
- факторы свертывания;
- Д-димер и др.
Чтобы выявить генную мутацию, необходимо дополнительно обследоваться.
Отдельное обследование назначают при подозрении на генетическую мутацию, чтобы выявить полиморфизм генов и подтвердить врожденную предрасположенность к заболеванию. Для этого необходимо выполнение специфических анализов.
Определение формы генетических особенностей дает возможность выбрать тактику лечения для пациентов, у которых обнаружилась генная мутация.
Анализ на наследственную тромбофилию включает обнаружение наиболее часто наследуемых полиморфизмов:
- гены свертывания крови — F2, фактор V-Лейден, F7, F13 и др;
- мутация антитромбина 3;
- дефицит протеинов С и S;
- ген MTHFR;
- ген ингибитора активатора плазминогена PAI-1 4G/5G и др.
Анализы можно сдать в лабораториях, где имеются все условия для изучения материала. В крупных медицинских центрах патология диагностируется с помощью специальной тест-системы «Кардиогенетика тромбофилии».
При планировании беременности проводят скрининг-тесты. Основное требование к подготовке — воздержание от пищи в течение 8 часов перед анализом.
Иногда необходима дифференциальная диагностика, чтобы отличить заболевание от гемофилии.
Расшифровка анализа, нормы и отклонения
Исследование может дать положительный результат.
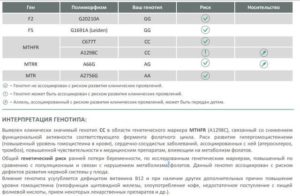
Генотип полиморфизма у пациента может быть представлен такими вариантами:
- GG — норма;
- А/А — гомозигота;
- G/А — гетерозигота.
Результаты анализа на тромбофилию указывают на присутствие или отсутствие мутации. Исследование крови может показать следующие результаты:
- Мутаций не выявлено.
- Гомозиготная — указывает на присутствие двух генов с измененной структурой, поэтому вероятность проявления заболевания высокая.
- Гетерозиготная. Означает, что пациент — носитель одного измененного гена, и вероятность заболевания невысокая.
| Уровень фибриногена | GG | GA | AA |
| F13 | GT | TT | |
| Фактор V-Лейдена | GA | AA | |
| F2 | |||
| Ингибитор активатора плазминогена | 5G/5G | 4G/5G | 4G/4G |
Оценивать данные, полученные в ходе исследования крови, должен профильный врач.
| Протромбированный индекс | 72—120% |
| Тромбированное время | 11—18 секунд |
| Свертывание | 5—10 минут |
| Активированное время рекальцификации | 50 -70 мин. |
| Антитромбин 3 | 72—126% |
| D-димер | 250—500 нг/мл |
| Фибриноген В | Негативный |
| Тромботест | IV-V степень |
При интерпретации результатов берут во внимание положение двух аллелей – форм одного и того же гена, расположенного в хромосомах:
- G/G – нормальный ген;
- G/A – гетерозиготная мутация;
- A/A – оба аллеля гена имеют дефекты (гомозиготная мутация).
| Фактор V (FV Leiden) Замена аргинина на глутамин в положении 506 |
Риск ишемического инсульта, венозных и артериальных тромбозов в молодом возрасте. Акушерские осложнения – фетоплацентарная недостаточность, ВЗР, выкидыши во II-м, III-м триместрах. |
| Янус-киназа (JAK-2) V617F |
Миелопролиферативные заболевания – патологии костного мозга (миелолейкоз, тромбоцитемия, миелофиброз). Самопроизвольное прерывание беременности. |
| Фактор VII (Hageman factor) | Гемофилия D, геморрагический диатез у новорожденных, болезнь Хагемана – врожденное нарушение свертывания крови. |
| Фактор I (FGB) G (-455) A |
Повышает риск инсульта при наличии артериальной гипертензии. Осложнения беременности – фетоплацентарная недостаточность, привычное невынашивание. |
| Фактор II (Протромбин) 20210 G{amp}gt;A |
Венозная тромбоэмболия. Отслойка нормально расположенной плаценты, выкидыши в I-м триместре, гестоз. |
| Метилен тетра гидрофолат редуктаза (MTHFR) 677 C{amp}gt;T |
Акушерские патологии: преэклампсия, ВЗР, поздний гестоз, антенатальная гибель плода, преждевременные роды. |
Лаборатория патологий гемостаза при МЖЦ работает 6 дней в неделю. Также у нас функционирует круглосуточная телефонная линия – позвоните нам прямо сейчас и забронируйте удобное для вас время посещения клиники!
